按下列要求回答
(1)除去下列不纯物质中的少量杂质(括号内为杂质),请填入适当的试剂
①Fe(Al) ②NH3(H2O)
③NO(NO2) ④NaCl溶液(Na2SO4)
(2)实验室配制100mL0.5mol·L‑1的Na2CO3溶液,回答下列问题:
①应用托盘天平称取碳酸钠粉末 g。
②配制时应选用的仪器有500mL溶量瓶,托盘天平、烧杯、药匙、 。
③若实验时遇到下列情况,所配溶液的浓度偏大的是 。
| A.加水定容时超过刻度线,又吸出少量至刻度线 |
| B.没有将洗涤液转入容量瓶 |
C.容量瓶洗涤后内壁有水珠而未作干燥 处理 处理 |
| D.定容时府视刻度线 |
由软锰矿(主要成分为MnO2)制备KMnO4的实验流程可表示如下:
(1)反应Ⅰ发生反应的化学方程式是 ;
反应Ⅱ发生反应的离子方程式是 ;
(2)操作Ⅲ的实验步骤为 、 ;可循环利用的物质的化学式为 ;
(3)计算用2.5kg含MnO280%的软锰矿制备,理论上可得KMnO4为 :
(4)取制得的产品6.5g,配成250mL溶液;准确称取纯Na2C2O41.34g配成适量溶液。用上述KMnO4溶液滴定Na2C2O4溶液,恰好反应(氧化产物为CO2,还原产物为Mn2+)时,消耗KMnO4溶液的体积为25.00mL。该KMnO4的纯度为 %(保留小树点后一位)。
(14分)金属铜具有良好的导电性和导热性,在电气和电子工业中应用广泛。请回答下列问题:
(1)资料显示:加热条件下氨气能够还原CuO得到金属铜。某同学用装置I和Ⅱ制取纯净干燥的氨气,装置I中应选用试剂______(供选用的试剂有:NH4Cl固体、NH4HCO3固体),试剂a最好选用__________,其作用是_________________________________________;装置III吸收尾气,如何检验所得溶液中数目最多的阳离子(只回答试剂名称和实验现象)_____________________。
(2)电解硫酸铜溶液也可得到金属铜。
①以黄铜矿(主要成份为CuFeS2)为原料采用电解法可制取硫酸铜溶液。实验室用如图所示装置模拟其过程,阳极区稀硫酸的作用是溶解矿粉得到Cu2+、Fe2+、H2S,硫酸铁的作用是氧化吸收H2S,防止逸出造成污染。电解过程中,阳极区Fe3+的浓度基本保持不变,原因是(用电极反应式回答)______________,阴极上先有固体析出,然后又溶解,阴极区通入O2的作用是(用离子方程式回答)__________________。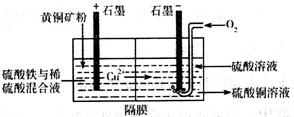
②用惰性电极电解一定浓度CuSO4溶液制取金属铜,一段时间后停止通电,此时加入9.8gCu(OH)2恰好能使电解质溶液恢复至初始状态,则该过程中阳极产生气体的体积为____________L(标准状况)。
(7分)工业尾气SO2、NO2是污染大气、形成酸雨的罪魁祸首。请回答下列问题:
(1)用CO可以消除SO2污染。已知一定条件下,2CO(g)+O2(g)==2CO2(g)的能量变化如图所示,由固体S单质生成l molSO2(g)的焓变为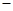 296kJ·mol
296kJ·mol 。
。
在相同条件下,CO与SO2反应生成单质S与CO2的热化学方程式为___________________________。
(2)异氰酸(化学式:HNCO,C为+4价)可用于消除尾气中的NO2。其反应原理为:
HNCO+NO2→N2+CO2+ (未配平)。
(未配平)。
①上述反应的氧化剂是____________。
②配平后方框内应填写____________。
③每处理33.6LNO2(标准状况),反应中转移电子的物质的量为____________。
(10分)为探究原电池和电解池的工作原理,某研究性小组分别用如图所示装置进行实验。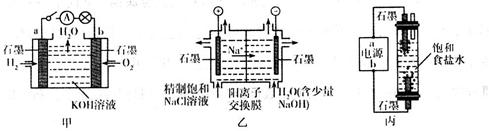
(1)甲装置中,a电极的反应式为________________________________________。
(2)乙装置中,阴极区产物为_________________________。
(3)丙装置是一种家用环保型消毒液发生器。外接电源a为_______(填“正”或“负”)极,该装置内发生反应的化学方程式为________________________________________________________。
(4)若甲装置作为乙装置的电源,一段时间后,甲中消耗气体与乙中产生气体的物质的量之比为____________(不考虑气体的溶解)。
(13分)已知A、B、C、D、E是原子序数依次增大的五种短周期元素,A、C同主族,A与B、A与E形成共价化合物,A与B形成化合物的水溶液呈碱性,E元素的最高正化合价与最低负化合价的代数和为6,D是同周期中离子半径最小的元素。
(1)五种元素中,非金属性最强的元素在周期表中的位置是__________________,写出C元素的原子结构示意图____________________。
(2)B元素的气态氢化物与其最高价氧化物对应的水化物反应生成的化合物中存在化学键的类型为___。
(3)C元素的最高价氧化物对应的水化物与D元素的最高价氧化物反应的化学方程式为_____________。
(4)已知X、Y、Z三种物质中均含有上述元素中的某一种元素,它们之间存在如图所示转化关系。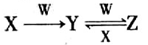
①X、Y、Z均含有同一种金属元素,若w固体俗称干冰,则反应Y→Z的离子方程式为__________;若w是强碱,且Y为白色难溶固体,则反应Z→Y的离子方程式为________________________。
②X、Y、Z是均含有同一种非金属元素的化合物,W是一种常见金属单质,且上述转化均在常温条件下完成,则反应Z→Y的离子方程式为_______________________________。