氧化还原反应在生产、生活中具有广泛的用途、贯穿古今。

(1)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用下图表达。试写出有水参加的符合反应类型Ⅳ的一个化学方程式: ,其中水为__ _剂。
(2)过氧化氢的水溶液俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:
①下列反应中,H2O2既体现氧化性又体现还原性的反应是( )
| A.Na2O2+2HCl ═ 2NaCl+H2O2 |
| B.Ag2O+H2O2 ═ 2Ag+O2↑+H2O |
| C.2H2O2 ═ 2H2O+O2↑ |
| D.3H2O2+Cr2(SO4)3+10KOH ═K2CrO4+3K2SO4+8H2O |
②保存过氧化氢的试剂瓶上最适合贴上的一个标签是( )(填序号)

(3)焊接铜器时,可先用NH4Cl 除去其表面的氧化铜再进行焊接,该反应可表示为:
4CuO+2NH4Cl △ 3Cu+CuCl2+N2↑+4H2O
①用双线桥标明电子转移的方向和数目。
。
②该反应中,被氧化的元素是 ,氧化剂是 。
③还原剂与氧化产物的物质的量之比为 。
④反应中若产生0.2 mol的氮气,则有 mol的电子转移。
实验室制氢氧化铁胶体将滴入 中,继续加热至液体呈红褐色时,用一束可见光照射可观察到现象,这一现象叫丁达尔现象,向胶体中逐滴滴入稀硫酸至过量可观察到现象,产生此现象的原因是。
智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为:
_____NaIO3+_______NaHSO3——_______NaHSO4+_____ Na2SO4+___I2+____H2O
(1)配平上述反应方程式并用双线桥标出电子转移的方向和数目
(2)反应中 元素被氧化,是氧化剂
(3)反应中,所得氧化产物和还原产物的质量之比为 。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液法 | B.结晶法 | C.分液法 | D.蒸馏法 E.过滤法 |
⑴分离饱和食盐水与沙子的混合物。
⑵分离水和汽油的混合物。
⑶分离四氯化碳(沸点为76.75℃)和甲苯的混合物(沸点为110.6℃)的混合物。
⑷从碘的水溶液里提取碘。
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:
①加入稍过量的Na2CO3溶液; ②加入稍过量的NaOH溶液;
③加入稍过量的BaCl2溶液;④滴入稀盐酸至溶液呈中性;⑤过滤
(1)下列操作顺序正确的是
| A.③②①⑤④ | B.①②③⑤④ | C.②③①⑤④ | D.③⑤②①④ |
 (2)如何用实验方法确定①中Na2CO3溶液已过量?
(2)如何用实验方法确定①中Na2CO3溶液已过量?
(3)若④和⑤两步操作反了可能造成什么后果?
。
(4)滴入稀盐酸至溶液呈中性涉及到的离子反应方程式
某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中 除Cu(OH)2外还有碱式硫酸铜【可表示为xCuSO4.yCu(OH)2】.为了加以验证,小组成员进行了如下实验:
除Cu(OH)2外还有碱式硫酸铜【可表示为xCuSO4.yCu(OH)2】.为了加以验证,小组成员进行了如下实验: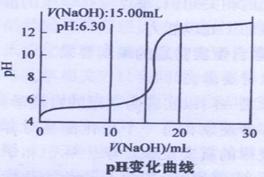
①分别配置50mL物质的量浓度均为0.100mol/L的CuSO4溶液和NaOH溶液;
②准确量取10mL CuSO4溶液倒入50ml烧杯中
③向烧杯中匀速加入0.100 mol/L的NaOH溶液,并每加入1.00mlNaOH溶液用pH计测一次混合溶液的pH
④当滴入NaOH溶液的体积达到30ml时停止实验,并绘制出向CuSO4溶液中滴加NaOH溶液时PH变化曲线。如右图
请回答下列问题:
(1)配置溶液时需要使用烧杯、、等玻璃仪器;下列仪器中可用于向烧杯中加入NaOH溶液的仪器是
| A.胶头滴管 | B.酸式滴定管 | C.碱式滴定管 | D.量筒 |
(2)V(NaOH)在2.00ml~15.00ml之间时,溶液中产生绿色沉淀,并不断增加,经检测此沉淀为碱式硫酸铜。当V(NaOH)为15.00ml时,溶液PH为6.32(已知蒸馏水的PH为6.32),则可求得x=y=
(3)V(NaOH)在17.00ml~20.00ml之间时,溶液中出现蓝色沉淀,并不断增加。已知V(NaOH)为20.00ml时,溶液PH为12.25,则此时沉淀中(填“含”或“不含”)有碱式硫酸铜,请设计实验方案加以证明: