含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO 还原为N2,从而消除污染。其反应的离子方程式是:
还原为N2,从而消除污染。其反应的离子方程式是:
6NO +10Al+18H2O
+10Al+18H2O →3N2↑+10Al(OH)3+6OH-
→3N2↑+10Al(OH)3+6OH-
(1)上述反应中,生成标准状况下33.6L氮气时,转移韵电子为 mol。现在要除去1m3含氮元素0.3mol的废水中的N0 (设氮
(设氮 元素都以NO
元素都以NO 的形式存在,下同),则至少需要消耗金属铝 g。
的形式存在,下同),则至少需要消耗金属铝 g。
(2)有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同,。
①写出镁和含氮废水反应的离子方程式
②已知金属镁可以从海水中提取的MgCI2通过电解制得的,电解熔融氯化镁的化学方程式为 , 若要除去1m3含氮元素0.3mol的废水中的NO
若要除去1m3含氮元素0.3mol的废水中的NO ,则至少需要含0.5%(质量分数)MgCl2的海水 kg。
,则至少需要含0.5%(质量分数)MgCl2的海水 kg。
铁和铜作为常见金属,在生活中有着广泛的应用。
(1)硫酸铁在工业上可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S。(CuFeS2中S为-2价)则下列说法正确的是(选填序号);
a.从物质分类的角度看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1mol电子时,46 g CuFeS2参加反应
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI + Hg = Cu2HgI4 + 2Cu,以上反应中的氧化剂为______; CuI可由Cu2+与I 直接反应制得,请配平下列反应的离子方程式:Cu2+ + I
直接反应制得,请配平下列反应的离子方程式:Cu2+ + I — CuI + I
— CuI + I
某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加人铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加人氨水有白色沉淀生成,继续加人过量氨水,沉淀不消失;
④取溶液少许,滴人氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴人硝酸银溶液产生白色沉淀,再加人过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是___________(填代号)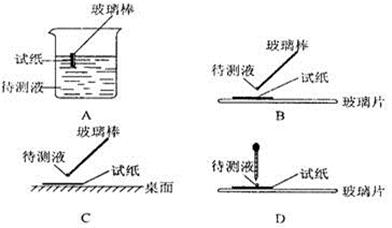
(2)根据上述实验判断原溶液中肯定存在的离子是______________________,肯定不存在的离子是______________________。
(3)写出与②实验有关的离子方程式:
_____________________________________________________________
I.(8分)A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有5个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A的最高价氧化物的水化物是___________(填化学式);
(2)物质E中所包含的化学键有______________,写出C、D两元素形成的化合物C2D的电子式______________________;
(3)把盛有48 mL AB、AB2混合气体的容器倒置于水中(同温、同压下),待液面稳定后,容器内气体体积变为24 mL,则原混合气体中AB的体积分数为__________。
II.(6分)下表为长式周期表的一部分,其中的编号代表对应的元素。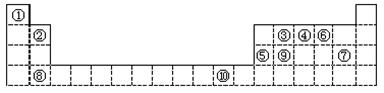
请回答下列问题:
(1)写出元素⑩的基态原子的电子排布式_________________。
(2)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子数为_____
(3)③④⑤三种元素的第一电离能由大到小的顺序是(填序号)___________。
某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为:
(2)A与溴的四氯化碳溶液反应的化学方程式为;反应类型是;
(3)已知: 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式;(仿照信息写出关系式即可)
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式;(仿照信息写出关系式即可)
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式;
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为。
用于2008年奥运会的国家游泳中心(水立方)的建筑采用了膜材料ETFE,它是乙烯—四氟乙烯的共聚物,具有许多优异的性能:
①具有特有的表面抗粘着的性能;
②使用寿命至少为25 ~ 35年,是用于永久性多层可移动屋顶结构的理想材料;
③达到B1、DIN4102防火等级标准,且不会自燃;
④质量很轻,只有同等大小的玻璃质量的1 %;
⑤韧性好、抗拉强度高、不易被撕裂,延展性大于400 %;
⑥能有效地利用自然光,透光率可高达95 %,同时起到保温隔热的性能,节省能源。(1)②说明ETFE的化学性质在自然条件下较__________ (填“稳定”或“活泼”);
(2)上述特点中,属于ETFE的物理性质的有________。(全对2分,有错、少选不给分)