本题含两小题,共14分。
(1)某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
①将Au2O3之外的物质分别填如以下空格内,配平后标出电子转移的方向和数目。
②反应中,被还原的元素是 ,还原剂是 。
③纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HC1,,则还原剂与氧化剂物质的量之比为
。
(2)按要求写出有水参与的氧化还原反应的化学方程式
①水是氧化剂:
②水是还原剂:
③水既不是氧化剂也不是还原剂:
由硫可制得多硫化钠Na2Sx,x的值一般为2~6。当x=2时,多硫化钠称为过硫化钠。
Ⅰ.过硫化钠加入盐酸中有硫沉淀析出,写出该反应的化学方程式,该反应的还原产物是。
Ⅱ.某些多硫化钠可用于制作蓄电池。下图是一种正在投入生产的大型蓄电系统的原理图。
电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过。电池充、放电的化学反应方程式为:


(1)电池中的左侧“电极”的电极名称是(填“正极”或“负极”)。
(2)放电过程中钠离子从(选“左到右”或“右到左”)通过离子交换膜。
(3)写出充电过程中阳极的电极反应式。
在容积为2L的密闭容器中,进行反应:A(g)+2B(g) C(g)+D(g)
C(g)+D(g)
在不同温度下,D的物质的量n(D)和时间t的关系如图所示。试回答下列问题:
(1)800℃时,0—5min内,以B的浓度变化表示的平均反应速率为。
(2)能判断该反应达到化学平衡状态的依据是。
a.容器中压强不变b.混合气体中c(A)不变
c.2v正(B)=v逆(D)d.A、B、C、D四者共存
(3)该反应的正反应为反应(填吸热或放热);判断的理由是。
(4)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K(要求有计算过程)。
有①~⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间。
| ② |
|||
| ⑦ |
⑧ |
(1)元素②在周期表中的位置为周期族;②、⑦、⑧三种元素的原子半径由小到大的顺序是(用元素符号表示)。②、⑦、⑧三种元素最高价氧化物对应水化物的酸性由强到弱的顺序是(用化学式表示)。
(2)如图所示,甲、乙、丙、丁均为①~⑧中某些元素形成的单质或化合物,反应a为置换反应,反应b为化合反应(反应条件已略去),单质乙与单质丙所含元素位于同一主族,任写一个符合条件的反应a的化学方程式:。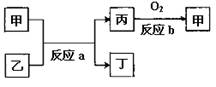
(共9分,每空1分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
。
(2)B为0.1 mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方
程式表示):;;
实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因:
。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入,目的是;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为
。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:
AgCl(S)  Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp = 1.8×10-10
Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp = 1.8×10-10
25℃时,现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.2 mol·L-1AgNO3溶液中;③100mL 0.1 mol·L-1氯化铝溶液中;④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是(填写序号);②中氯离子的浓度为mol·L-1
(共6分,每空2分)一定温度下,向如图所示的带有可移动活塞的密闭容器中充入2 L SO2和1 L O2的混合气体,发生如下反应2 SO2 (g) + O2 (g)  2 SO3(g) 。
2 SO3(g) 。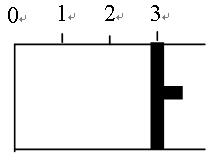
(1)若活塞可自由移动,平衡后,活塞停止在“2.1”处,则该反应中SO2的转化率为________。
(2)若开始时,充入容器的起始物质分别是
①2 L SO2和1 L O2;
②2 L SO3 (g) 和 1 L N2 ;③1 L SO2、1 L O2和 1 L SO3 (g),使活塞固定在“3”处,达到平衡后,容器中SO3 (g)的体积分数大小关系是(用序号和“<”、“=”、“>”表示)。
(3)向(1)平衡后的容器中充入0.2 mol 的SO3,活塞移动后再次达到平衡时,测得此过程中从外界共吸收了1.96 kJ 的热量。写出SO2发生氧化反应的热化学方程式:________。