某芳香烃A有如下转化关系: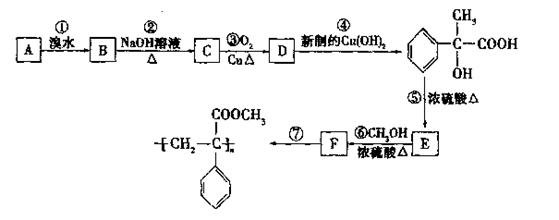
(1)反应②和⑤的类型:②属于 反应;⑤属于 反应。
(2)A、F的结构筒式A ;F 。
(3)反应③、⑥的化学方程式:
③ ;
⑥ 。
(4)D还可以和新制的银氨溶液反应,化学反应方程式为: 。
(5)有机物E有多种同分异构体,请写出与E具有相同官能团的所有同分异构体(不含E): 。
化学反应2A(g) B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0。反应物A的浓度(mol·L-1)随时间(min)的变化情况如下表:
| 实验序号 |
温度 |
0 min |
10 min |
20 min |
30min |
40min |
50 min |
60min |
| 1 |
800℃ |
1.0 |
0.8 |
0.67 |
0.57 |
0.5 |
0.5 |
0.5 |
| 2 |
800℃ |
c2 |
0.6 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
| 3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.6 |
0.6 |
0.6 |
| 4 |
820℃ |
1.0 |
0.4 |
0.25 |
02 |
0.2 |
02 |
02 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10min至20min时间内v(A)的平均速率为mol·L-1·min-l
(2)在实验2中A的初始浓度为mol·L-1,由实验2的数据,可推测实验2中还隐含的条件是。
(3)设实验3的反应速率为v3,实验1的反应速率为vl,则v3 (填“>”、“<”或“="”)" vl。且c3(填“>”、“<”或“="”)1.0" mol·L-1。
(4)比较实验4和实验1,可推测该反应是(填“吸热”或“放热”)反应,
可逆反应3A(g)3B(?)+C(?) ΔH>0达到化学平衡后,
(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量 。
②若B、C都不是气体,气体的平均相对分子质量 。
③若B是气体,C不是气体,气体的平均相对分子质量 。
如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,
则B是态,C是 态。
在一定条件下,可逆反应:mA+nBpC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是 。
(2)A、C是气体,增加B的量,平衡不移动,则B为态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是 。
(4)加热后,可使C的质量增加,则正反应是反应(填“放热”或“吸热”)。
(1)写出下列物质在水溶液中电离的方程式
HNO3HClO
NaHCO3
(2)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________。
(3)己知:①H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
③C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
④C(s)+ O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
回答下列问题:
①上述反应中属于放热反应的是_________________。
②H2的燃烧热为_______________,C的燃烧热为__________________.
③燃烧l0gH2生成液态水,放出的热量为_________________.
④CO的燃烧热为___________,其热化学方程式为_______________________.
(14分)金刚烷是一种重要的化工原料,工业上可通过下列途径制备: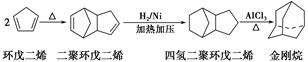
请回答下列问题:
(1)环戊二烯分子中最多有______个原子共平面。
(2)金刚烷的分子式为__________。
(3)下面是以环戊烷为原料制备环戊二烯的合成路线: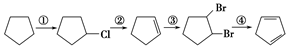
其中,反应②的反应试剂和反应条件是___________,反应③的反应类型是____________,反应④的化学方程式为。
(4)已知烯烃能发生如下反应: 。
。
请写出下列反应产物的结构简式: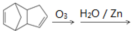 ____________________________。
____________________________。
(5)A是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色,A经酸性高锰酸钾溶液加热氧化可以得到对苯二甲酸( )[提示:苯环上的烷基(—CH3,—CH2R,—CHR2)或烯基侧链经酸性高锰酸钾溶液氧化得羧基(—COOH)]
)[提示:苯环上的烷基(—CH3,—CH2R,—CHR2)或烯基侧链经酸性高锰酸钾溶液氧化得羧基(—COOH)]
写出A所有可能的结构简式(不考虑立体异构):___________________________________。