重铬酸钠(Na2Cr2O7)广泛用于合成颜料、媒染剂等,以铬铁矿(主要成分为Cr2O3,还有FeO、Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程图如下: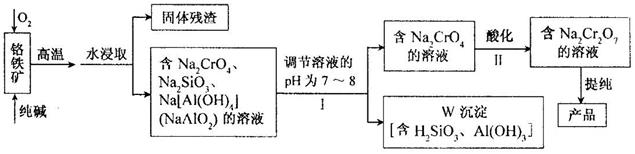
请回答下列问题。
⑴铬铁矿中的Cr2O3与纯碱、O2在高温下反应的化学方程式为 ▲ 。
⑵若Ⅰ中只用一种试剂调节溶液的pH,应选用 ▲ (填标号)。
A.稀硫酸 B.氧化钠固体 C.氢氧化钾溶液
⑶Ⅰ中,调节溶液pH后,如果溶液的pH过小,可能导致W沉淀部分溶解,原因是:
▲ 。(用离子方程式表示)。
⑷Ⅱ中,Na2CrO4转化为Na2Cr2O7的离子反应如下:
2CrO42-(黄色)+2H+ Cr2O72-(橙红色)+H2O
Cr2O72-(橙红色)+H2O
①该反应 ▲ (填“是”或“不是”)氧化还原反应。
②若往Na2Cr2O7溶液(橙红色)中加入足量NaOH固体,溶液 ▲ (填标号)。
A.变黄色 B.颜色不变 C.橙红色变深
③已知:25℃,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7的Ksp=2×10-7。25℃,往Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是 ▲ 。
A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图所示(图中球与球之间连线代表化学键单键或双键)。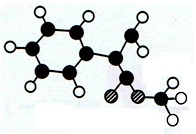
(1)根据分子结构模型写出A的结构简式______________________________。
(2)A在酸性条件下水解生成有机物B和甲醇,与B互为同分异构体的C:含苯环,能发生银镜反应,且苯环上只有一个支链。则C的结构简式为(写二种)_______________、_______________。
(3)拟以芳香烃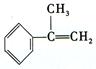 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下: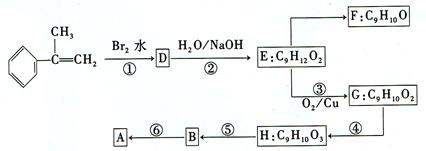
①写出反应类型:反应①属_______________反应,反应④属_______________反应,反应⑤属_______________反应。
②写出结构简式:D_______________,H_______________。
③已知在F分子中含“CH3OH”,通过F不能有效地、顺利地获得B,其原因是___________________________________________。
④写出反应方程式(注明必要的反应条件):
D→E:____________________________________________________________;
B→A:____________________________________________________________。
有常见A、B、C三种短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个;甲、乙、丙是三种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7,丁为气体,戊为淡黄色固体,甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图: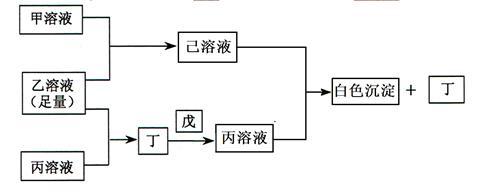
请回答:
(1)写出C元素的原子结构示意图__________________________。
写出丁和戊的电子式:__________________________。
(2)用有关化学用语解释乙溶液呈酸性的原因:__________________________。
丙溶液呈碱性的原因:_______________________________________。
(3)写出有关反应的离子方程式:_____________________________。
①乙溶液+丙溶液→丁:_____________________________________________。
②己溶液+丙溶液→丁:_____________________________________________。
(1)下列实验设计或操作合理的是_________________。
a. 中和热测定实验时,如果没有环形玻璃棒,可用环形铜质搅拌棒代替。
b. 实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂。
c. 实验室制取乙烯时必须将温度计的水银球插入反应液中,测定反应液的温度。
d. 向Na2CO3与NaOH的混合溶液中加入足量的CaCl2溶液,再滴加几滴酚酞试液,可检验NaOH的存在。
e. 将10滴溴乙烷加入1 mL 10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子。
(2)①取等体积、等物质的量浓度的盐酸和乙酸溶液分别与等量(足量)相同的锌反应,通过生成H2的快慢证明乙酸是弱酸。取用“相同”的锌的目的是_____________________________,比较生成H2快慢的方法是_____________
______________________________________。
②做溴乙烷水解实验时,不断振荡乙烷与NaOH溶液混合物的作用是____________________,溴乙烷已完全水解的现象是___________________。
有机化学反应因反应条件不同,可生成不同的有机产品。例如: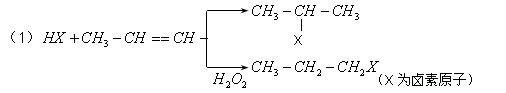
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。
工业上利用上述信息,按下列路线合成结构简式为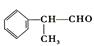 的物质,该物质是一种香料。
的物质,该物质是一种香料。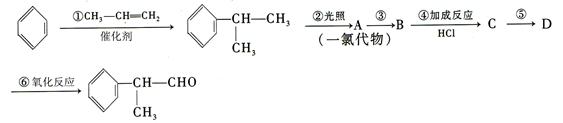
请根据上述路线,回答下列问题:
(1)A的结构简式可能为_____________________________________。
(2)反应①、③、⑤的反应类型分别为_____________、_____________、____________。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):
____________________________________________________________________。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是_______________________________________________。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:
写出符合上述条件的物质可能的结构简式(只写两种):___________________________。
物质的转化关系如下图所示(有的反庆可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。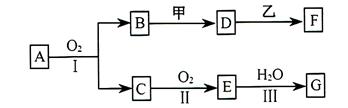
(1)若A为黄色固体,C能使品红试液褪色,D的水溶液中加入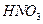 酸化的
酸化的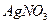 溶液有白色沉淀生成。则
溶液有白色沉淀生成。则
①工业上反应I在________________中进行,反应Ⅱ在_____________(均填设备名称)中进行。工业上反应Ⅲ用于吸收E的试剂是____________。
②由两种单质直接化合得到甲的反应条件是____________或________________。
③反应I的化学方程式是_______________________________。
④D和乙反应的离子方程式是___________________________________。
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。
则①甲的电子式是________________________。
②D的溶液与乙反应的离子方程式是____________________________。
③若1.7g A与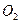 反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式:___________________________________。
反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式:___________________________________。