Ⅰ.已知测定中和热的实验步骤如下:①量取50mL 0.25 mol/L硫酸倒入小烧杯中,测量温度 ②量取50mL 0.55mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。请回答:
(1)NaOH溶液稍过量的原因 。
(2)加入NaOH溶液的正确操作是 (填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是 。
(4)设溶液的密度均为1g·cm-3,中和后溶液的比热容c="4.18" J·(g·℃)-1,请根据实验数据求出中和热为 写出该反应的热化学方程式_________
(5)若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量 (填“小于”、“等于”或“大于”)57.3 kJ,原因是
Ⅱ.某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用碱式滴定管量取25.00 mL烧碱溶液于锥形瓶中,并滴入几滴酚酞作指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为M的标准硫酸溶液装入润洗好的酸式滴定管中,调节液面使开始读数为V1 mL
E.在锥形瓶下垫一张白纸,滴定至溶液恰好由红色变为无色时,记下读数为V2 mL
试填空:
(1)正确操作步骤的顺序是 (用字母表示)。
(2)观察滴定管液面的高度时应注意
(3)E步骤的操作中锥形瓶下垫一张白纸的作用是 。
(4)某学生实验时把锥形瓶用烧碱样品溶液洗涤,使测定的浓度_________(填“偏高”“偏低”或“无影响”),原因是
(5)该烧碱样品纯度的计算式为_________________________。
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。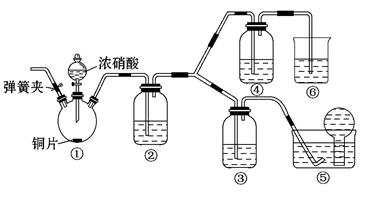
可选药品:浓硝酸、3 mol·L-1稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。
已知:氢氧化钠溶液不与NO反应,能与NO2反应:
2NO2+2NaOH====NaNO2+NaNO3+H2O
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是
。
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹后
。
(3)装置①中发生反应的化学方程式是
。
(4)装置②的作用是 ,
发生反应的化学方程式是
。
(5)该小组得出结论的实验现象是
。
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是 (选填序号字母)。
a.加热该绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
资料显示:“氨气可在纯氧中安静燃烧……”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。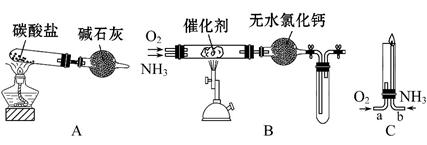
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是 ;碱石灰的作用是 。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热。氨催化氧化的化学方程式是;
试管内气体变为红棕色,该反应的化学方程式是
。
(3)将过量的氧气与A产生的氨气分别由a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
①两气体通入的先后顺序是 ,
其理由是 。
②氨气燃烧的化学方程式是 。
某同学用下列装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究,回答下列问题。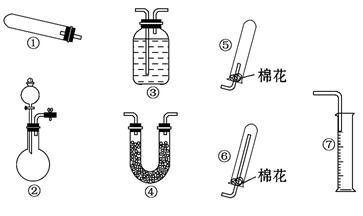
(1)若用装置①制取NH3,其反应的化学方程式为
;
若要测定生成的NH3的体积,则必须选择的装置是 (填装置序号),装置中所盛试剂应具有的性质是 。
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂是 ,分液漏斗中装的试剂是 ,收集装置应选择 (填装置序号)。证明氨气已收集满的操作是 。检验装置②的气密性的方法是 。
已知:Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O。为探究如何尽可能多地使NO2被水吸收,某活动小组设计并完成了以下实验。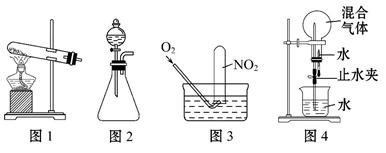
(1)活动小组同学利用铜与浓硝酸反应制取NO2、过氧化氢溶液与MnO2制取O2。
①根据反应原理他们选用了相同的装置 (填“图1”或“图2”)分别制取NO2和O2。
②写出铜与浓硝酸反应的离子方程式 。
③过氧化氢溶液与MnO2制取O2时,MnO2的作用是
_________________________________________________________________。
④收集NO2可采用的方法是 。
(2)活动小组的同学做了如下准备:用气囊收集好纯净的O2;收集了一试管NO2;用干燥的烧瓶收集了一定比例的NO2和O2混合气体。
①为了尽可能多地使NO2被水吸收,并达到较好的实验效果,利用图3吸收气体时,用气囊通入O2与直接利用制气装置制取并通入O2相比,其优点是
。
②利用图4吸收气体时,其操作和现象为
。
③NO2、O2、H2O反应的产物为硝酸,反应中NO2和O2物质的量之比a∶b= ;标准状况下,若图4中混合气体NO2和O2比例为a∶b,当混合气体全部被吸收时所得溶液物质的量浓度为 mol·L-1(保留两位有效数字)。
某课外活动小组探究镁与CO2、NO2的反应。
(1)实验发现点燃的镁条能在CO2气体中继续燃烧,产生黑、白两种固体,请用化学反应解释该现象 。
(2)该小组采用类比Mg与CO2反应的思路对Mg与NO2的反应进行预测:写出Mg与NO2反应的化学方程式 。
(3)设计实验验证猜测(用于连接玻璃管的乳胶管均内衬锡纸)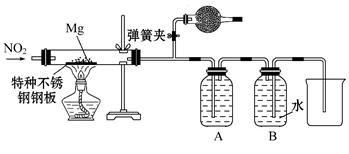
资料信息:2NO2+2NaOH====NaNO3+NaNO2+H2O。
①装置A中的试剂是 。
②干燥管和装置B的作用分别是 、
。
③实验开始时正确的操作步骤是 。
a.通入NO2
b.打开弹簧夹
c.点燃酒精灯
d.当硬质玻璃管充满红综色气体后,关闭弹簧夹