Ⅰ.在一定温度下,把2 mol N2和6 mol H2通入一个体积不变的密闭容器中(如图)发生以下的反应: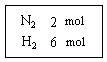
N2(g)+3 H2(g)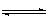 2NH3 (g) (正反应为放热反应)
2NH3 (g) (正反应为放热反应)
若反应达到平衡后,测得混和气体为7 mol ,据此回答下列问题:保持上述反应温度不变,使a、b、c分别代表初始加入的N2、H2和NH3的物质的量,如果反应达到平衡后混和气体中各物质的物质的量分数仍与上述平衡时完全相同,那么:
(1)若a="1" mol ,c="2" mol ,则b="____" mol,在此情况下,反应起始时将向 方向进行(填 “正”或“逆”)
(2)若规定起始时反应向逆反应方向进行,则c的范围是 。
(3)在上述装置中,若需控制平衡后的混和气体的物质的量为6.5 mol,则可采取的措施是
Ⅱ.如图所示,温度不变时,把某容器分割成A、B两部分,A容器体积固定不变,B有可移动的活塞,现在A中充入2 mol SO2和1 mol O2,在B中充入2 mol SO3和 1 mol N2,在相同条件下发生可逆反应:2 SO2(g)+O2(g) 2 SO3(g)。根据下列要求填写空白:
2 SO3(g)。根据下列要求填写空白: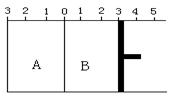
(1)固定活塞位置在3处不动,达到平衡时,设A中压强为PA,B中压强为PB,则PA与PB的关系是PA PB(填“<”、“=”、“>”)。
(2)若要使A与B中平衡状态相同,可移动活塞的位置应在 处。
(3)若活塞右移到5处,达到平衡后,B中SO3为x mol,A中SO3为y mol , 则x和y 的关系是x y. (填“<”、“=”、“>”)。
为提纯下列物质(括号内为少量杂质),填写除杂质试剂及方法:
| 不纯物 |
除杂试剂 |
分离方法 |
| 苯(苯酚) |
||
| 乙醇(水) |
写出下列化学方程式,并注明反应类型
(2)溴乙烷与氢氧化钠的醇溶液在加热条件下反应,反应类型:。
(3)苯酚与溴水的反应,反应类型:。
4分)写出以下键线式所表示的有机物的结构简式: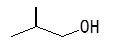
,属于该类有机物的同分异构体还有种。
用质量分数为37.5%的浓盐酸(密度为1.16 g / cm3)配制成1 mol / L的稀盐酸。现实验室仅需要这种盐酸220 mL。试回答下列问题:
(1)配制稀盐酸时,应选用容量为mL的容量瓶;
(2) 经计算需要mL浓盐酸,在量取时宜选用下列量筒中的。
| A.5 mL | B.10 mL | C.25 mL | D.50 mL |
(3) 在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸其温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
② 往容量瓶中小心加蒸馏水至液面接近环形标线2~3 cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的环形标线相切。
③ 在盛盐酸的烧杯中注入蒸馏水几十毫升,并用玻璃棒搅动,使其混合均匀。
④ 用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)。
(4) 在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是
(填“偏高”、“偏低”、“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是(填“偏高”、“偏低”、“无影响”)。
用20g烧碱配制成500mL溶液,其物质的量浓度为mol/L;从中取出1mL,其物质的量浓度为mol/L;含溶质g。若将这1mL溶液用水稀释到100mL,所得溶液中溶质的物质的量浓度为mol/L,其中含Na+g。