在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式__________________________________________。
(2)已知H2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知N2(g)+2O2(g)="===2" NO2(g);△H="+67.7" kJ·mol-1,N2H4(g)+O2(g)="==" N2(g)+2H2O (g);△H="-534" kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式
________________________________________。
(16分)用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下(部分操作和条件略):
已知:一定条件下,MnO4 可与Mn2+反应生成MnO2
可与Mn2+反应生成MnO2
(1)稀H2SO4溶解Al2O3的离子方程式是__________________。
(2)已知:生成氢氧化物沉淀的pH如下表(注:金属离子的起始浓度为0.1mol·L-1)
| Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
|
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
上述流程中,加入过量KMnO4溶液的作用是________________________。(用离子方程式表示)
(3)向滤渣B中加入浓盐酸并加热,能说明沉淀中存在MnO2现象是____________。
上述流程中加入MnSO4体的目的是_______。操作a由一系列操作组成,分别是_____、___、过滤。
(4)若用沉淀溶解平衡原理分析,操作a能析出A12(SO4)3·18H2O的原因是①_______②________。
(17分)氢气和氨气都属于无碳清洁能源。
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2 MH2x(s)△H<0(M表示某种合金)
MH2x(s)△H<0(M表示某种合金)
下图表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系。则下列说法中,正确的是______
| A.T1>T2 |
| B.增大氢气压强,加快氢气的吸收速率 |
| C.增大M的量,上述平衡向右移动 |
| D.在恒温、恒容容器中,达平衡后充入H2,再次平衡后的压强增大 |
(2)以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体。乙装置中a、b为石墨电极,电解过程中,b极质量增加。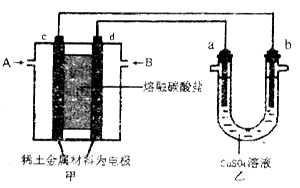
①工作过程中,甲装置中d电极上的电极反应式为____________________。
②若用该装置电解精炼铜,则b极接____(填“粗铜”或“精铜”);若用该装置给铁制品上镀铜,则____(填“a”或“b”)极可用惰性电极(如Pt电极),若电镀量较大,需要经常补充或更换的是_______。
(3)氨在氧气中燃烧,生成水和一种空气组成成分的单质。
已知:①N2(g)十3H2(g)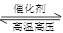 2NH3(g)△H=
2NH3(g)△H= 92.4kJ·mol-1
92.4kJ·mol-1
②2H2(g)十O2(g)=2H2O(1)△H=-572KJ·mo1-1
试写出氨气在氧气中燃烧生成液态水的热化学方程式___________________。
(4)在一定条件下,将lmolN2和3molH2混台于一个10L的密闭容器中发生反应:
N2(g)+3H2(g)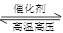 2NH3(g)
2NH3(g)
5min后达到平衡,平衡时氮气的转化率为a。
①该反应的平衡常数K=________,(用含a的代数式表示)
②从反应开始到平衡时N2的消耗速率v(N2)=____mo1·L-1·min-1。(用含a的代数式表示)
双氧水是一种重要的消毒剂,实验室可用下列流程制取双氧水,请根据转化关系图回答下列问题: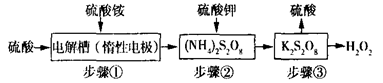
(1)电解槽中阳极反应式为,步骤②、③反应方程式分别为、
(2)从步骤②得到K2S2O8、从步骤③得到H2O2溶液的操作分别是。
| A.结晶分液 | B.过滤萃取 |
| C.过滤减压蒸馏 | D.蒸馏减压蒸溜 |
(3)整个实验过程中,能循环利用的物质是。
(4)为测定产品中H2O2的浓度,量取样品50 mL,在250mL容量瓶中定容。准确量取25.00 mL于锥形瓶中,加入1 mL 6 mol·L—1的硫酸,然后用0.100 0 mol·L—1KMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液10.00 mL。
2MnO4— +5H2O2+6H+=2Mn2++ 5O2↑+8H2O
①如何判定滴定达到终点?。
②根据滴定结果,可确定产品中H2O2的浓度为g·L—1。
③若滴定前滴定管尖嘴处无气泡,滴定后产生气泡(其他操作均正确),会使测得的H2O2的浓度(选填:“偏高”、“偏低”或“不变”)。
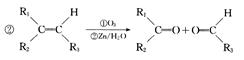
(13分)四川北川盛产蔷薇科植物。蔷薇科植物中含有一种芳香醛(用E表示),在染料工业和食品工业上有着广泛的用途,下面是它的一种合成路线。


其中0.l mol有机物 A 的质量是 12g ,在足量的氧气中充分燃烧后生成0.8mol CO2和 7 . 2gH2O; D 能使溴的四氯化碳溶液褪色, D 分子与 C 分子具有相同的碳原子数; F 继续被氧化生成 G , G 的相对分子质量为 90 。
已知: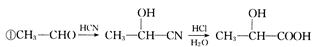


回答下列问题:
(l)A的结构简式为__________________。
(2)A~G中能发生酯化反应的有机物有:(填字母序号)
(3)C在浓硫酸加热的条件下时,分子内脱水除生成D外还可以生成另一种有机物,写出该反应的方程式:;该反应类型是
(4)C 的同分异构体有多种,其中符合下列要求的有机物有多种。
①能与3 mol NaOH溶液反应②苯环上的一卤代物只有一种
写出所有满足条件有机物的结构简式______________________________
(5)C与4-甲基-2,3-戊二醇两分子之间1:1发生取代反应,生成的有机物有种。
周期表中有X、Y、Z三种元素,已知:①X原子核外电子排布占有3个轨道,并且其第一电离能在同周期中按由大到小的顺序排列居第三位。②Y位于X的相邻周期,且Y最外层的p轨道有一个未成对电子。③Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。请回答:
(1)Z元素原子的价电子排布式为,其能与一些分子或离子形成配合物,[Z(CN)6]4-中离子CN-的电子式为。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是此液体具有的性质是。
A.光束通过该液体时形成光亮的“通路”
B.插入电极通直流电后,有一极附近液体颜色加深
C.向该液体中加入硝酸银溶液,无沉淀生成
D.将该液体加热、蒸干、灼热后,有氧化物生成
(3)①常温下,将20mL 0.1mol·L—1Y的最高价氧化物对应水化物的水溶液与VmL 0.1mol·L—1 X气态氢化物的水溶液混合后pH=7,则V20mL(填“>”“<”或“=”)。
②常温下,将pH=2的Y的最高价氧化物对应水化物的水溶液V1mL与V2mL0.0lmol·L—1X气态氢化物的水溶液混合后,溶液呈酸性,则V1与V2的关系满足
A.V1>V2B.V1<V2C.V1=V2D.无法确定
此时溶液中离子浓度大小顺序可能为
A.c(YO4—)>c(XH4+)>c(H+)>c(OH—)
B.c(YO4—)>c(H+)>c(XH4+)>c(OH—)
C.c(YO4—)>c(XH4+)=c(H+)>c(OH—)
D.c(H+)>c(YO4—)>c(XH4+) >c(OH—)
(4)氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②
4NH3(g)+5O2(g)  4NO(g)+6H2O(g);△H=-905kJ/mol①
4NO(g)+6H2O(g);△H=-905kJ/mol①
4NH3(g)+3O2(g)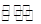 2N2(g)+6H2O(g);△H=-1268kJ/mol②
2N2(g)+6H2O(g);△H=-1268kJ/mol②
下列说法正确的是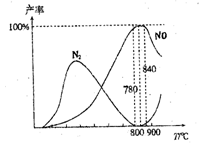
A.工业上进行氨催化氧化生成NO时,温度应控制在 7800C~8400C之间,且7800C时的平衡常数大于8400C时的平衡常数
B.工业上采用物料比n(O2)/n(NH3)在1.7~2.0之间,主要是为了提高反应速率
C.在加压条件下生产能力可提高5~6倍,主要是因为加压可提高原料的转化率
D.氮气氧化为NO的热化学方程式为:N2(g)+O2(g)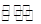 2NO(g); △H=-181.5kJ/mol
2NO(g); △H=-181.5kJ/mol