过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。根据下列
反应回答问题:
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)上述反应中,H2O2仅体现氧化性的反应是(填代号,下同) ,H2O2既体现氧化性又体现还原性的反应是 ,H2O2体现酸性的反应是 。
(2)上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序是 。
(3)保存过氧化氢试剂瓶上的最适合贴上的一个标签是 (填序号);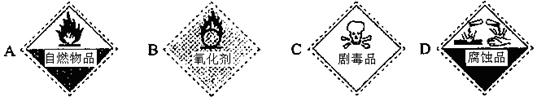
(4)某强酸反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:
O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2。
①反应体系选择的酸是: (填序号)。
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子为 mol。
(5)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的
氰化物(如KCN),经以下反应:KCN+H2O2+H2O=A+NH3↑,试指出生成物A的化学式为 ,并阐明H2O2被称为绿色氧化剂的理由是 。
对于混合物的分离或者提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取、加热分解 等。下列各组混合物的分离或提纯应采用什么方法?
等。下列各组混合物的分离或提纯应采用什么方法?
(1)实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
(2)提取碘水中的碘,用方法。
(3)除去食盐溶液中的水,可采用方法。
(4)淡化海水,可采用方法。
(5)除去氧化钙中的碳酸钙,可用方法。
在 K2Cr2O7 + 14HCl ="===" 2KCl + 2CrCl3 + 3Cl2+ 7H2O反应中。
="===" 2KCl + 2CrCl3 + 3Cl2+ 7H2O反应中。
(1)元素被氧化,是氧化剂,氧化产物是;
(2)此反应若转移了12mol的电子,则生成氯气L(标准状况)
含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO 还原为N2,从而消除污染。其反应的离子方程式是:
还原为N2,从而消除污染。其反应的离子方程式是:
6NO +10Al+18H2O
+10Al+18H2O →3N2↑+10Al(OH)3+6OH-
→3N2↑+10Al(OH)3+6OH-
(1)上述反应中,生成标准状况下33.6L氮气时,转移韵电子为mol。现在要除去1m3含氮元素0.3mol的废水中的N0 (设氮
(设氮 元素都以NO
元素都以NO 的形式存在,下同),则至少需要消耗金属铝g。
的形式存在,下同),则至少需要消耗金属铝g。
(2)有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同,。
①写出镁和含氮废水反应的离子方程式
②已知金属镁可以从海水中提取的MgCI2通过电解制得的,电解熔融氯化镁的化学方程式为, 若要除去1m3含氮元素0.3mol的废水中的NO
若要除去1m3含氮元素0.3mol的废水中的NO ,则至少需要含0.5%(质量分数)MgCl2的海水kg。
,则至少需要含0.5%(质量分数)MgCl2的海水kg。
盐酸、硫酸和硝酸是中学阶段所常见的“三大酸”。现请就三大酸与金属铜反应情况,填空回答下列问题: (1)我们知道,稀盐酸不与Cu反应,但在稀盐酸中加入H2O2后,则可使铜顺利溶解,该反应的化学方程式为_。
(1)我们知道,稀盐酸不与Cu反应,但在稀盐酸中加入H2O2后,则可使铜顺利溶解,该反应的化学方程式为_。
(2)在一定体积的18 mol/L的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为
0.9mol。则浓硫酸的实际体积____(填写“大于”、“等于”、或“小于”)100mL,你认为其主要原因是。
若 使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(
使剩余的铜片继续溶解,可在其中加入硝酸盐溶液( 如KNO3溶液),则该反应的离子方程式为。
如KNO3溶液),则该反应的离子方程式为。
(3)分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈
绿色,后者呈蓝色,某同学提出这可能是溶液中Cu2+与NO2共存的结果,请你设
计实验探究此说法正确与否(简述实验方案和实验现象及由此得出的结论)
。
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水、生成Zn(NH3) 。回答下列问题:
。回答下列问题:
(1)铝的氢氧化物溶于盐酸的离子方程式为。
(2)写出锌和氢氧化钠溶液反应的化学方程式。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是____
①硫酸锌和氨水②硫酸铝和氨水
③硫酸锌和氢氧化钠④硫酸铝和氢氧化钠
(4)写出可溶性铝盐与氨水反应 的离子方程式
的离子方程式 。
。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因。