右图为实验室某浓盐酸试剂瓶标签上的有关数据,根据有关数据回答下列问题:
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:1.19g/m3 质量分数:36.5% |
(1)该浓盐酸中HCl的物质的量浓度为 mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量不随所取体积多少 而变化的是 。
A、溶液中HCl的质量 B、溶液的p H
C、溶液中H+的数目 D、溶液的密度
(3)欲配制上述浓盐酸,需要在1L水中通入标态下 L
HCl气体(保留1位小数)
(4)现有1L1mol/L的稀盐酸,欲使其浓度增大1倍,采取的措施合理的是 。
A、通入标况下HCl气体22.4L B、将溶液加热浓缩至0.5L
C、加入5mol/L的盐酸0.6L,再稀释至2L。 D、加入1L 3mol/L的盐酸混合均匀。
(7 分)某消毒液的主要成分为 NaClO(混有少量NaCl),请用相应的化学用语来解释下列事实。
(1)该消毒液可用NaOH 溶液吸收Cl2 制备,化学方程式为 。
(2)该消毒液的pH 约为12,离子方程式为 。
(3)向FeSO4溶液中滴入少量该溶液,溶液颜色变成棕黄色,反应的离子方程式为 。
(4)该消毒液不能与洁厕灵(主要成分为浓盐酸)混用,否则会产生中毒危险。每产生1 mol Cl2(标准状况下),转移电子个数约为 。
(8分)有A、B、C三种无色溶液,它们分别为葡萄糖溶液、蔗糖溶液、淀粉溶液中的一种,经实验可知:
①B能发生银镜反应;②A遇碘水变蓝色;③A、C均能发生水解反应,水解液均能发生银镜反应。
(1)试判断它们各是什么物质:
A是________,B是________,C是________。
(2)分别写出A、C发生水解反应的化学方程式:
A__________________________________
C:________________________________。
已知乳酸的结构简式为 。试回答:
。试回答:
①乳酸分子中含有________和_________两种官能团(写名称);
②乳酸与足量金属钠反应的化学方程式为___________________;
(6分)根据结构对有机物进行分类,有助于对其性质的掌握。
①下列有机物属于芳香烃的是 (填字母),
a. b.
b.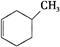 c.
c.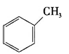
②下列有机物属于羧酸类的是 (填字母)。
a.CH3CHOb.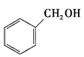 c.
c.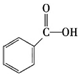
③下列有机物属于糖类的是 (填字母)。
a.油脂b.纤维素c.蛋白质
已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
(1)A分子中官能团的名称是 ,反应①的化学反应类型是 反应。
(2)反应④的化学方程式是 。
(3)某同学用如图所示的实验装置制取少量乙酸乙酯。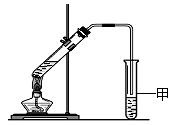
实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
①实验开始时,试管甲中的导管不伸入液面下的原因是 。
②若分离出试管甲中该油状液体需要用到的仪器是________(填序号)。
a.漏斗 b.分液漏斗 c.长颈漏斗
③实验结束后,若振荡试管甲,会有无色气泡生成,其主要原因是 (结合化学方程式回答)。