.在一密闭气缸中,用一不漏气可滑动的活塞隔开,左边充有N2,右边充有H2和O2的混合气体,在20℃时,将右边混合气体点燃,反应后冷却到原来温度,若活塞原来离气缸左端的距离为总长的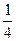 ,反应后静止于气缸的正中(忽略水蒸气),则原来H2和O2的体积比为________________
,反应后静止于气缸的正中(忽略水蒸气),则原来H2和O2的体积比为________________
(l0分)用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定质量的HA配制0.lmol/L的溶液100mL;
②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH1(选填>、<、=)
乙方案中,说明HA是弱电解质的现象是(多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处
(4)请你再提出一个合理且比较容易操作的方案(药品可任取),作简明扼要表述。
(l4分)(1)①常温下,0.01mol/L的二元酸H2A溶液的pH=5,其电离方程式为________。
②用Al 2(SO4)3与NaHCO3溶液混合反应就是泡沫灭火器的工作原理,请写出反应的离子方程式________________________________________________________。
2(SO4)3与NaHCO3溶液混合反应就是泡沫灭火器的工作原理,请写出反应的离子方程式________________________________________________________。
③比较0.1mol/L的下列各种溶液的pH大小:
CH3COONa___________NaClO;CuSO4_________KHCO3。(填“>”、“<”或“=”)
(2) 25℃ 时,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=10。试回答以下问题:
时,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=10。试回答以下问题:
①混合溶液中由水电离出的c(H+)________0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合物中下列算式的计算结果(填具体数 字):
字):
c(A-)+c(HA)=mol/L;c(OH-)-c(HA)=mol/L。
在含 b mol AlCl3的溶液中加入含 a mol NaOH的溶液。
(1)、当a≤3b(即铝盐过量)时,生成Al(OH)3 沉淀的物质的量为mol。
(2)、当a≥4b时,生成Al(OH)3 沉淀的物质的量为mol。
(3)、当3<a/b<4时,先有沉淀生成,后又有部分沉淀溶解,此时Al(OH)3的物质的量为mol。
(4)、请写出AlCl3与NaOH溶液反应时三个有关的离子方程式或化学方程式:
①:
②:
③:
(10分)某化学研究性学习小组通过分组实验来探究盐酸与醋酸电离程度的差异,探究过程如下表: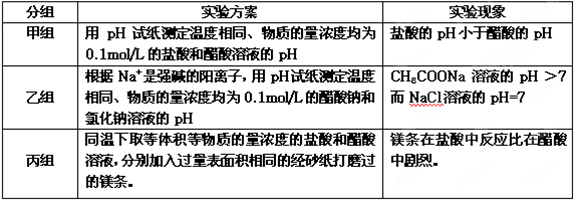
(1)、若甲、乙两组同学用pH试纸测溶液的pH时,均先用蒸馏水润湿pH试纸后再分别测定盐酸、醋酸、醋酸钠、氯化钠4种溶液的pH值,这种操作会导致上述所测的三种溶液的pH值出现偏差,不会出现偏差的溶液是 :,测得溶液pH>7的有:。
(2)、丙组实验中的两种溶液反应后,收集到的气体体积__(填“相等”或“ 不相等”)。
不相等”)。
(3)、以上3组实验中能证明醋酸是弱酸的是:_及 丙 组(填“甲”、“乙”或“丙”,下同),能证明盐酸是强酸的是__组。
(9分)在一定条件下,下列反应达到化学平衡:2HI(g) H2(g)+I2(g)(正反应为吸热反应)
H2(g)+I2(g)(正反应为吸热反应)
(1)如果升高温度,平衡混合物的颜色
(2)如果加入一定量的H2,平衡 移动
(3)如果使密闭容器的体积增大,平衡 移动