下列说法中不正确的是
| A.1mol任何物质都含有6.02×1023个原子 |
| B.0.012kg12C含有约6.02×1023个碳原子 |
| C.在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类 |
| D.物质的量是国际单位制中七个基本物理量之一 |
用NA表示阿佛加德罗常数的值,下列叙述中正确的是( )
| A.在标准状况下,完全燃烧2.24L辛烷可生成CO2分子数为0.8NA |
| B.常温常压下,30g乙酸与30g葡萄糖含有的氧原子数都是NA |
| C.1mol -OH所含的电子数为17NA |
| D.1mol Cl2通入足量的NaOH溶液中充分反应转移的电子数为2NA |
A+B→X+Y+H2O(未配平,反应条件略去)是中学常见反应的化学方程式,其中A、B的物质的量之比为1:4。请回答:
(1)若Y是黄绿色气体,则Y的电子式是,该反应的化学方程式是:
。
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是。
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中
①A元素在周期表中的位置是(填所在周期和族);Y的化学式是。
②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是mol。
(4)若A、B、X、Y均为化合物。A溶于水电离出的阳离子和水作用的生成物可净化水,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是。
25℃时,某硫酸铜溶液的溶质质量分数为w,物质的量浓度为cmol/L,密度为ρg/mL,将此溶液蒸去a g水或再向原溶液中加入b g无水硫酸铜粉末,充分静置并恢复至25℃时,均恰好全部转化为CuSO4·5H2O晶体。则下列关系式正确的是()
A. |
B.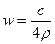 |
C.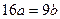 |
D.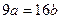 |
关于下列各图的叙述正确的是()
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
铅蓄电池是典型的可充电电池,在现代生活中有着广泛的应用,其充电、放电按下式进行:
有关该电池的说法正确的是()
| A.放电时,蓄电池内电路中H+ 向负极移动 |
| B.放电时,每通过1mol电子,蓄电池就要消耗2mol H2SO4 |
| C.充电时,阳极反应:PbSO4 +2e- = Pb + SO42- |
| D.充电时,铅蓄电池的负极与外接电源的负极相连 |