(12分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)  CH3OH(g),不同温度时甲醇的物质的量随时间变化曲线如下图所示。根据题意完成下列各题:
CH3OH(g),不同温度时甲醇的物质的量随时间变化曲线如下图所示。根据题意完成下列各题: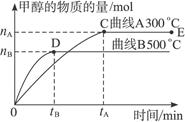
(1)反应达到平衡时,升高温度,v正_____________ (填“增大”“减小”或“不变”)。化学平衡向 移动
(2)500 ℃,从反应开始到平衡,H2的反应速率v(H2)=________________________。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是_____________。
| A.氢气的浓度减小 | B.正反应速率加快,逆反应速率也加快 |
| C.甲醇的物质的量增加 | D.重新平衡时n(H2)/n(CH3OH)增大 |
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是__________________________(用化学方程式表示)。
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:
(1)“O”点导电能力为0的理由是
(2)a、b、c三点溶液中c(H+)由大到小的顺序是(用a、b、c字母表示)
(3)a、b、c三点中醋酸的电离程度最大的是;(用a、b、c字母表示)
(4)若使c点溶液中c(CH3COO‑)增大,溶液中c(H+)减小,在如下措施中可选择:
(填序号)
①加热;②加少量NaOH固体;③加水;④加少量CH3COONa固体;⑤少量加冰醋酸
已知常温下,氨水中NH3·H2O的电离平衡常数:K=1.6×10-5;若NH3·H2O的起始浓度为1mol·L-;则平衡时c(OH-)=
下列各物质的溶液物质的量浓度均为0.1 mol·L-1
①HCl ②NaOH ③ Na2CO3④CH3COONa ⑤NH4Cl ⑥Ba(OH)2⑦KCl ⑧ CH3COOH
按它们的pH由小到大的排列的顺序为(填序号)
物质A~G有下图所示转化关系(部分反应物、生成物没有列出)。其中A为某金属矿的主要成分,经过一系列反应可得到B和C。单质C可与E的浓溶液发生反应,G为砖红色沉淀。(提示:葡萄糖结构简式为CH2OH(CHOH)4CHO )
请回答下列问题:
(1)写出下列物质的化学式:B、E、G
(2)利用电解精炼法可提纯C物质,在该电解反应中阳极电极材料是,阴极电极材料是,电解质溶液是
(3)反应②的化学方程式是。
(4)将0.23 mol B和0.11 mol氧气放入容积为1 L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12 mol D,则反应的平衡常数K =(保留一位小数)若温度不变,再加入0.50 mol氧气后重新达到平衡,则:
B的平衡浓度(填“增大”、“不变”或“减小”),
氧气的转化率(填“升高”、“不变”或“降低”),
D的体积分数(填“增大”、“不变”或“减小”)。
(19分)
Ⅰ:现有CH4、C2H4、C2H2、C2H6、C3H8五种有机物,回答下列问题:
⑴质量相同时:在相同状况下体积最大的是__ ____,完全燃烧时消耗O2的量最多的是__ __,生成CO2最多的是___ _,生成水最多的是___ ___。
⑵同温同压同体积时,五种物质完全燃烧消耗O2的量最多的是__
Ⅱ:有机化学中的反应类型较多,将下列反应归类(填序号)。
①乙苯的制备: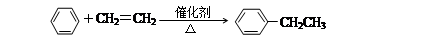
②乙烷在空气中燃烧③乙烯使溴的四氯化碳溶液褪色④乙烯使酸性高锰酸钾溶液褪色⑤由乙烯制聚乙烯⑥甲烷与氯气在光照的条件下反应⑦溴乙烷和氢氧化钠的乙醇溶液共热⑧由甲苯制取TNT
(1)其中属于取代反应的是;
属于氧化反应的是;属于加成反应的是;
属消去反应的是属于聚合反应的是
(2)写出⑦和⑧的化学方程式
⑦
⑧
Ⅲ:医药阿斯匹林的结构简式如图1所示: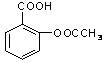
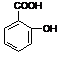
图1图2
试根据阿斯匹林的结构回答;
⑴阿斯匹林看成酯类物质,口服后,在胃肠酶的作用下,阿斯匹林发生水解反应,生成A和B 两种物质。其中A的结构简式如图2所示,则B的结构简式为;B中含有的官能团名称是。
⑵阿斯匹林跟NaHCO3同时服用,可使上述水解产物A与NaHCO3反应,生成可溶性盐随尿液排出,此可溶性盐的结构简式是
⑶写出阿斯匹林与足量氢氧化钠溶液共热的化学反应方程式