已知一定温度和压强下,N2(g)和H2(g)反应生成2molNH3(g),放出92.4kJ热量。在同温同压下向密闭容器中通入1molN2和3molH2,达平衡时放出热量为Q1kJ;向另一体积相同的容器中通入0.5molN2和1.5molH2,相同温度下达到平衡时放出热量为Q2kJ。则下列叙述正确的是 ( )
| A.2Q2>Q1="92.4kJ" | B.2Q2=Q1="92.4kJ" | C.2Q2<Q1<92.4kJ | D.2Q2=Q1<92.4kJ |
高温下,某反应达平衡,平衡常数K=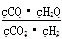 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应的化学方程式为CO+H2O CO2+H2 CO2+H2 |
铁路氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,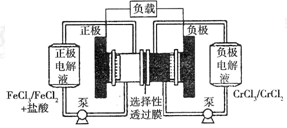
工作原理为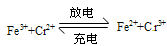 下列说法一定正确的是
下列说法一定正确的是
| A.电池充电时,阴极的电极反应式为Cr3++e-=Cr2+ |
| B.电池放电时,负极的电极反应式为Fe2+-e-=Fe3+ |
| C.电池放电时,Cl-从负极穿过选择性透过膜移向正极 |
| D.电池放电时,电路中每通过0.1mol电子,Fe3+浓度降低0.1mol·L-1 |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法正确的是
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
| C.电池反应的化学方程式为:CH3CH2OH+O2=CH3COOH+H2O |
| D.正极上的反应式:O2+4e—+2H2O=4OH- |
关于下列各装置图的叙述不正确的是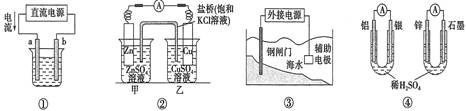
| A.用图①装置精炼铜,a极为粗铜,电解质溶液为CuSO4溶液 |
| B.图②装置中盐桥中的Cl-移向乙烧杯 |
| C.图③装置中钢闸门可与外接电源的负极相连受到保护 |
| D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同 |
下列说法正确的是
| A.25℃时,pH为9的Na2CO3溶液和pH为5的NaHSO4溶液中,水的电离程度相同 |
| B.在含Al3+的KNO3溶液中,可通过加热法除去Al3+,证明盐的水解是吸热反应 |
| C.已知HF的酸性比HCN的酸性强,则等体积等浓度NaF和NaCN两溶液中阳离子的物质的量之和相等 |
| D.等物质的量浓度的①NH4Cl ②NH4HSO4③Na2S ④NaNO3⑤(NH4)2SO4,其pH由大到小的排列为③>④>⑤>①>② |