对于反应KMn04+ HCl—KC1+ MnCl2+Cl2+ H20(未配平),若有0.1 mol KMn04参加反应,下列说法正确的是 ( )
| A.转移0.5 mol电子 | B.生成0.5 mol Cl2 |
| C.参加反应的HC1为1.6 mol | D.Cl2是还原产物 |
下列反应中,反应后固体物质增重的是()
| A. | 氢气通过灼热的 粉末 | B. | 二氧化碳通过 粉末 |
| C. | 铝与 发生铝热反应 | D. | 将锌粒投入 溶液 |
四联苯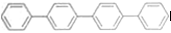 的一氯代物有
的一氯代物有
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
下列过程没有发生化学反应的是()
| A. | 用活性炭去除冰箱中的异味 |
| B. | 用热碱水清除炊具上残留的油污 |
| C. | 用浸泡过高锰酸钾溶液的硅藻土保存水果 |
| D. | 用含硅胶、铁粉的透气小袋与食品一起密封包装 |
已知:锂离子电池的总反应为:
 锂硫电池的总反应为:
锂硫电池的总反应为:

有关上述两种电池说法正确的是
| A. | 锂离子电池放电时, 向负极迁移 |
| B. | 锂硫电池充电时,锂电极发生还原反应 |
| C. | 理论上两种电池的比能量相同 |
| D. | 右图表示用锂离子电池给锂硫电池充电 |
下列有关电解质溶液中粒子浓度关系正确的是
| A. | =1的 溶液: |
| B. | 含有 和 固体的悬浊液: |
| C. | 的水溶液: |
| D. | 含等物质的量的 和 的溶液: |