甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族。x、 A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同,G的焰色反应为黄色。在一定条件下,各物质相互转化关系如下图:
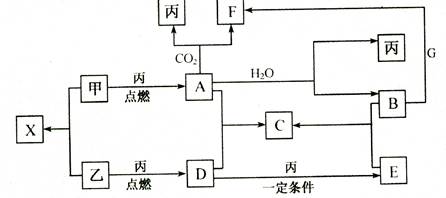
(1)用化学式表示:丙为 ,C为
(2)X的电子式为 。
(3)写出A与H2O反应的化学方程式:
(4)写出B与G溶液反应的离子方程式:
【化学-物质结构与性质】原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素。回答下列问题:
(1)甲能形成多种常见单质,在熔点较低的单质中,每个分子周围紧邻的分子数为;在熔点很高的两种常见单质中,X的杂化方式分别为、。
(2)14g乙的单质分子中π键的个数为___________。
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第
二电离能I2,依次还有I3、I4、I5…,推测丁元素的电离能突增应出现在第电离能。
(4)戊的基态原子有种形状不同的原子轨道;
(5)丙和丁形成的一种离子化合物的晶胞结构如图,该晶体中阳离子的配位数为。距一个阴离子周围最近的所有阳离子为顶点构成的几何体为。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a=__________cm。 (用含ρ、NA的计算式表示)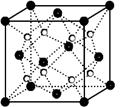
(6)甲、乙都能和丙形成原子个数比为1:3的常见微粒,推测这两种微粒的空间构型为
已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,A、B含同一种元素。(某些产物可能略去) 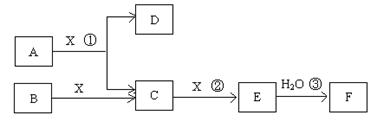
请回答下列问题:
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应。
①写出A与X反应的化学方程式:。
②有人认为“浓H2SO4可以干燥气体E”。某同学为了验证该观点是否正确,用下图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,由此你得出的结论是。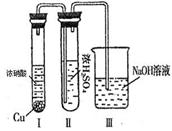
③已知常温下1 mol气体E发生反应③放出46kJ热量,写出气体E与H2O反应的热化学方式。
④在常温下,向V1L pH=a的A溶液中加入V2L pH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则V1和V2的关系为V1V2(填>、<、无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是。(写出一种情况即可)
(2)若E为无色无味气体,F是二元弱酸。
①E的电子式为;
②将少量气体E通入氢氧化钡溶液中得不溶物G,G的KSP=8.1×10-9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其KSP,(填:增大、减小或不变),此时,组成不溶物G的阴离子在溶液中的浓度为mol/L。
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为;砷与溴的第一电离能较大的是。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为,与其互为等电子体的一种分子为。
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为,As原子采取杂化。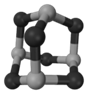
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与个Ga相连,As与Ga之间存在的化学键有(填字母)。
| A.离子键 | B.氢键 | C.配位键 | D.金属键 E.极性键 |
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)一定条件下,在一个密闭容器中充入气体:N2 2mol、H2 6mol,达平衡后N2的转化率为50%,同时放热92.3KJ。该反应的热化学方程式为:______________________________。
(2)传统哈伯法合成氨工艺中相关的反应式为:N2+3H2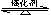 2NH3。
2NH3。
①该反应的平衡常数K的表达式为:K=______________。升高温度,K值______(填“增大”“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1∶3)。分析表中数据,(填温度和压强)。时H2转化率最高,实际工业生产中不选用该条件的主要原因是。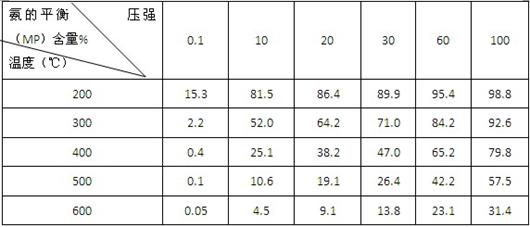
③下列关于合成氨说法正确是(填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于ΔH<0、ΔS>0,故合成氨反应一定能自发进行
(3)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2=2N2+6H2O,你认为电解质溶液应显性(填“酸性”、“中性"、“碱性”),写出负极电极反应式。
(4)工业上净化处理铬污染方法之一是:将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
已知电解后的溶液中c(Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为mol/L。
[化学—选修5:有机化学基础]
分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物质,某实验室的科技人员设计了下列合成路线: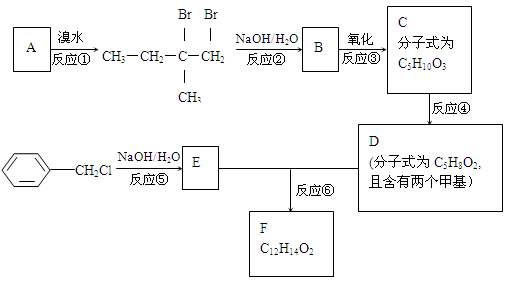
试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现 种峰;峰面积比为
(2)C物质的官能团名称
(3)上述合成路线中属于取代反应的是(填编号);
(4)写出反应⑤、⑥的化学方程式:
⑤
⑥
(5)F有多种同分异构体,请写出符合下列条件的所有结构简式:①属于芳香族化合物,且含有与F相同的官能团;②苯环上有两个取代基,且苯环上的一氯代物只有两种;③其中一个取代基为-CH2COOCH3;