(1)49gH2SO4的物质的量是 ,将其配制成200mL溶液,所得溶液的物质的量浓度为 ,其中含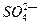 个,该溶液能与标准状况下的氨气 L恰好完全反应生成(NH4)2SO4。
个,该溶液能与标准状况下的氨气 L恰好完全反应生成(NH4)2SO4。
(2)由硫酸钾、硫酸铝和硫酸组成的混合溶液,其PH=1,c(Al3+)="0.4mol/" L, c(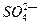 )="0.8" mol/ L, 则c(K+)为 。
)="0.8" mol/ L, 则c(K+)为 。
(3)将标准状况下a L HCl(g)溶于1000 g水中,得到盐酸的密度为bg/ cm3,则该盐酸的物质的量浓度是 。
下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32。
请按要求填空:
⑴反应③的化学方程式______________。
(2)写出制取化合物L的离子方程式______________。
(3)C的结构式______________;H的化学式______________。
(4)L的溶液与化合物E反应的离子方程式______________。
(5)化合物J的化学式______________,写出与化合物J等电子体的分子的分子式(2种)
______________
A、B、C、D、E是中学化学常见的5种化合物,其中A、B是氧化物。单质X、Y是生活中常见的金属,相关物质间的转化关系如下图所示(部分反应物与产物已略去):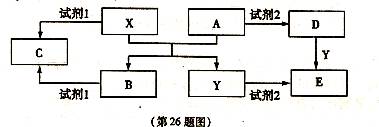
(1)若试剂l与试剂2不属于同类物质,则X与试剂l反应的离子方程式是。
(2)若试剂1和试剂2相同,且E溶液加热蒸干并灼烧后可得到A,则A的化学式是。
①检验物质D的溶液中金属离子的实验操作是。
②将物质C溶于水,其溶液呈(填“酸性”、“中性”或“碱性”),原因用离子方程式可表示为。
(3)若E溶液隔绝空气加热蒸干后可得到该溶液的溶质,工业上以E、稀硫酸和NaNO2为原料来制备高效净水剂Y(OH)SO4,反应中有N0生成,该反应的化学方程式是。
.下表是部分短周期元素的原子半径及主要化合价:
| 元素代号 |
W |
R |
X |
Y |
Z |
Q |
M |
| 原子半径/nm |
0.037 |
0.186 |
0.074 |
0.075 |
0.077 |
0.110 |
0.160 |
| 主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2,+4 |
-3,+5 |
+2 |
试回答下列问题:
(1)七种元素中原子半径最大的元素在周期表中位置是。M在Z的最高价氧化物中燃烧的化学方程式为。
(2)元素Z可形成多种同素异形体,其中有属于原子晶体的,写出它的名称
(3)X可与R按1:l的原子个数比形成离子化合物甲,甲中存在的化学键有;X可与w组成含18电子的共价化合物乙,则乙的电子式为。
(4)M的最高价氧化物的水化物难溶于水,已知298K时,该物质的的KSP=5.6×10-12,若此时测得溶液pH=13.00,则此温度下残留在溶液中的M离子物质的量浓度为mol·L-1。
(5)向含4mol Y的最高价氧化物对应的水化物的稀溶液中,逐渐加入铁粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(Fe2+)随n(Fe )变化的示意图,并标出n(Fe 2+)的最大值。
常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_____________________________________________。
(2)若溶液M由10 mL 2 mol·L-1NaHA溶液与2 mol·L-1NaOH溶液等体积混合而得,则溶液M的pH________7(填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为_____________________________________________。
已知Ksp(BaA)=1.8×10-10,向该混合溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为__________ mol·L-1。
(3)若溶液M由下列三种情况:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为________;pH由大到小的顺序为____________。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为____(填“大于”“等于”“小于”或“均有可能”)。
氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据上面的能量变化示意图,请写出NO2和CO反应的热化学方程式。
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g)△H < 0,
2NH3(g)△H < 0,
其平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
4.1×106 |
K1 |
K2 |
①该反应的平衡常数表达式:K=
②试判断K1K2(填写“>”,“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是(填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)对反应N2O4(g) 2NO2(g)△H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是。
2NO2(g)△H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是。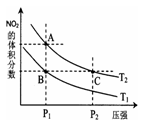
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率a(N2)=,以NH3表示该过程的反应速率v(NH3)= 。