三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料
Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是 。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? 。
(3)若固体粉末完全溶解无固体存在, 滴加 KSCN 试剂时溶液不变红色, 则证明原固体粉末是 ,写出所有发生的反应的离子方程式 。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b > a),则混合物中Cu2O的质量分数为 。
(5)实验小组欲利用该红色粉末制取较纯净的胆矶 (CuSO4 . 5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2 +、Fe2+、Fe3+分别生成沉淀的pH 如下:
| 物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀pH |
6.0 |
7.5 |
1.4 |
| 沉淀完全pH |
13 |
14 |
3.7 |
实验室有下列试剂可供选择:
| A.氯水 | B.H2O2 | C.NaOH | D.Cu2(OH)2CO3 |
实验小组设计如下实验方案:
试回答:
试剂1为 ,试剂2为 (填字母序号);固体x的化学式是 。
氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.001 mol·L-1KMnO4酸性溶液和未知浓度的无色NaHSO3溶液。反应离子方程式是2 +
+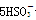 +H+===2Mn2++5
+H+===2Mn2++5 +3H2O,填空回答问题:
+3H2O,填空回答问题:
(1)该滴定实验所需仪器有下列中的________(填序号)。
| A.酸式滴定管(50 mL) | B.碱式滴定管(50 mL) |
| C.量筒(10 mL) | D.锥形瓶 |
E.铁架台 F.滴定管夹
G.烧杯 H.白纸
I.胶头滴管 J.漏斗
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因:
________________________________________________________________________。
(3)选何种指示剂,说明理由
________________________________________________________________________。
(4)滴定前平视KMnO4液面,刻度为a mL,滴定后俯视液面刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积偏________(填“多”或“少”)。根据(b-a) mL计算得到的待测浓度,比实际浓度偏________(填“大”或“小”)。
菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸 发生化反应的产物。
发生化反应的产物。
(1)甲一定含有的官能团的名称是_____________________。
(2)5.8 g甲完全燃烧可产生0.3 mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是_____________________________。
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写出任意2种的结构简式)___________________。
(4)已知:
菠萝酯的合成路线如下:
①试剂X不可选用的是(选填字母)____________。
a.CH3COONa溶液 b.NaOH溶液 c.NaHCO3溶液d.Na
②丙的结构简式是_________________,反应Ⅱ的反应类型是___________。
③反应Ⅳ的化学方程式是
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了、性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
。
2g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
MnO4-+Fe2++H+=Mn2++Fe3++H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为 mol。
(3)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为g。
(4)混合物中Cu2S的质量分数为。
(1)用5.0 mol·L-1的NaOH溶液配制0.1mol·L-1的NaOH溶液时,下图所示的仪器中,肯定不需要的是________(填序号),配制上述溶液还需要的玻璃仪器是________________________________________________(填仪器名称).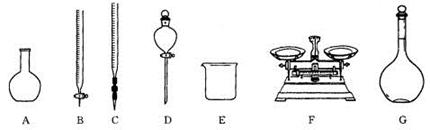
(2)在配制过程中,下列操作将导致实际所配NaOH溶液浓度偏低的是(填编号)________.
①准确取出的浓NaOH溶液在空气中露置时间过长;②用量器将浓NaOH溶液直接加入容量瓶,缓慢加入蒸馏水至液面最低点恰好和环形刻度线相切;③摇匀后,液面低于刻度线,再加蒸馏水至液面最低点恰好和环形刻度线相切;④稀释NaOH溶液的仪器未洗涤.