设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A.标准状况下,5.6 L H2O含有的分子数为0.25nA |
| B.标准状况下,22.4 L H2和Cl2的混合气体中含有的分子数为2nA |
| C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3nA |
| D.常温常压下,58.5 g NaCl中含有的Na+离子数为nA |
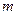 g铜与足量浓H2SO4共热时恰好完全反应,在标准状况下生成
g铜与足量浓H2SO4共热时恰好完全反应,在标准状况下生成 L气体,则被还原的H2SO4的量是
L气体,则被还原的H2SO4的量是
A. mol mol |
B. mol mol |
C. g g |
D. g g |
A、B、C、D为四种短周期元素,已知A、C同族,B、D同周期,A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;若B的阳离子比C的阴离子少一个电子层,下列叙述正确的是
A.原子序数:A>B>D>C B.单质熔点:D>B>C>A
C.原子半径:D>B>C>A D.简单离子半径:C>A>D>B
碱金属钫(Fr)具有放射性,下列对其性质的预言中,错误的是
| A.在碱金属元素中它的原子核对最外层电子的引力最大 |
| B.钫在空气中燃烧时,只生成化学式为Fr2O的氧化物 |
| C.它的氢氧化物化学式为FrOH,是一种极强的碱 |
| D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸 |
工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法正确的是
| A.该反应属于复分解反应 | B.该反应利用了Cl2的强氧化性 |
| C.若管道漏气遇氨就会产生白烟 | D.生成1molN2有3mol电子转移 |
短周期金属元素甲~戊在周期表中的相对位置如表所示,下面判断不正确的是
| 甲 |
乙 |
|
| 丙 |
丁 |
戊 |
| A.原子半径:丙<丁<戊 | B.金属性:甲<丙 |
| C.氢氧化物碱性:丙>丁>戊 | D.最外层电子数:甲>乙 |