碳和碳的化合物在生产生活实际中应用广泛。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知 ① 2 CH4 (g) + 3O2 (g) = 2 CO (g) + 4 H2O(l) △H1 = -1214.6 KJ/mol
② 2 CO (g) + O2(g) = 2 CO2 (g) △H2 = -566 kJ/mol
则反应CH4(g) + 2 O2 (g) = CO2 (g) + 2 H2O (l) 的△H = 。
(2)若用石墨做电极电解饱和食盐水,则电解反应的离子方程式为: ;
(3)将不同量的CO (g) 和H2O (g) 分别通入到体积为1L的恒容密闭容器中,进行反应 CO (g) + H2O (g) CO2 (g) + H2 (g),得到如下三组数据:
CO (g) + H2O (g) CO2 (g) + H2 (g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
| H2O |
CO |
CO2 |
CO |
|||
| 1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
| 3 |
900 |
2 |
4 |
0.8 |
3.2 |
2 |
① 实验1中以υ(H2) 表示的反应速率为 。
② 实验2中的平衡常数是 (计算结果保留两位小数)。
③ 该反应的正反应为 (填“吸”或“放”)热反应。
工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。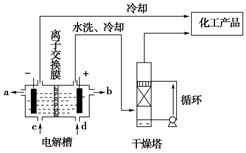
(1)上图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是______;NaOH溶液的出口为________(填字母);精制饱和食盐水的进口为________(填字母);干燥塔中应使用的液体是________。
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为______________________________________________________。
②SiCl4可转化为SiHCl3而循环使用,一定条件下,在20 L恒容密闭容器中的反应:
3SiCl4(g)+2H2(g)+Si(s)4SiHCl3(g)
达平衡后,H2和SiHCl3物质的量浓度分别为0.140 mol/L和0.020 mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为______kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0 kg,则生成氢气________m3(标准状况)。
氢氧化钠是一种用途十分广泛的重要化工原料。工业上主要通过电解氯化钠饱和溶液的方法获得氢氧化钠,我国的氯碱工业大多数采用离子交换膜电解槽。
(1)离子交换膜电解槽一般采用金属钛作阳极,其原因是
阴极一般用碳钢网制成。阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是________________________________________________________________________。
(2)为使电解氯化钠的速率加快,下列措施可行的是________。
a.增大阴极碳钢网的面积
b.提高饱和氯化钠溶液的温度
c.加大阴极与阳极间的距离
d.提高电解时电源电压
(3)如果将某离子交换膜电解槽①电解时的电压增大到原来的2倍;②电解时的电流强度增大到原来的2倍;③电解时温度从30 ℃提高到60 ℃,则电解速率一定会达到原来2倍的是________。
如图是用石墨和铁作电极电解饱和食盐水的装置。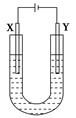
请填空:
(1)X的电极名称是________极,电极反应式为_______________________________,
Y极的电极材料是____________________________________________________。
检验X极产物的方法是_____________________________________________________。
(2)某同学在实验时误将两种电极材料接反,导致X极上未收集到预期产物。一段时间后又将两极的连接方式纠正过来,发现X一端出现了白色沉淀,此沉淀是________(填化学式)。其形成原因是___________________________________________________________________,
该沉淀在空气中放置,现象是______________________________________________________。
(3)工业上电解饱和食盐水的方法之一是将两个极室用离子交换膜隔开(如图),其目的是________________________________________________________________________,阳极室(A处)加入__________,阴极室(B处)加入__________,离子交换膜只允许________通过。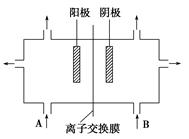
氯碱工业中用离子交换膜法电解制碱的主要生产流程示意图如下: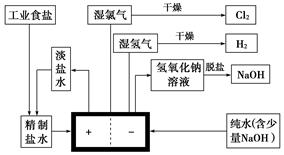
依据上图完成下列填空:
(1)与电源正极相连的电极上所发生反应的电极反应式为____________________;与电源负极相连的电极附近,溶液的pH________(填“不变”、“升高”或“降低”)。
(2)工业食盐含Ca2+、Mg2+、Fe3+等杂质,精制过程中发生反应的离子方程式为_________________________________________________________________________。
(3)如果粗盐中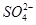 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去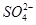 ,该钡试剂可以是________(填字母代号)。
,该钡试剂可以是________(填字母代号)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、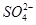 ,加入试剂的合理顺序为________(填字母代号)。
,加入试剂的合理顺序为________(填字母代号)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过______、冷却、______(填写操作名称)除去NaCl。
(6)由图示可知用离子交换膜法电解制碱工艺中________产品可循环使用。
(7)已知NaCl在60 ℃的溶解度为37.1 g,现电解60 ℃精制饱和食盐水1371 g,经分析,电解后溶液密度为1.37 g·cm-3,其中含有20 g NaCl,则电解后NaOH的物质的量浓度为________mol·L-1。
利用天然气合成氨的工艺流程示意图如下:
依据上述流程,完成下列填空:
(1)n mol CH4经一次转化后产生CO 0.9n mol,产生H2________mol(用含n的代数式表示)。
(2)K2CO3溶液和CO2反应在加压条件下进行,加压的理论依据是________(填字母代号)。
a.相似相溶原理 b.平衡移动原理 c.酸碱中和原理
(3)由KHCO3分解得到的CO2可以用于________(写出CO2的一种重要用途)。
(4)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3溶液循环,三是________循环。