(10分,每空1分)某同学在探究废干电池内的黑色固体回收利用时,进行如图示实验:
查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、三角架 、 ;
(2)操作④的试管加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气
体,据此可初步认定黑色固体为 。
(3)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测
滤渣中还存在的物质为 。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出 其空白处的内容:
其空白处的内容:
| 实验目的 |
操作 |
实验现象 |
结论 |
| 1、检验Cl— |
取少许滤液于试管中, |
|
含有Cl— |
| 2、检验NH4+ |
取少许滤液于试管中, |
|
含有NH4+ |
| 3、检验Zn2+ |
取少许滤液于试管中,加入 稀氨水 |
先产生白色沉淀,继续加入氨水,沉淀又溶解 |
含有Zn2+ |
(5)根据以上的实验报告,关于滤液的成分,你的结论是: 。通过一定的操作从滤液中得到固体溶质, 若要将所得固体溶质中的物质加以分离,可用 法。
下表为周期表的一部分,其中的编号代表对应的元素。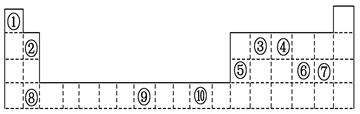
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)写出元素⑨的基态原子的电子排布式 。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为 对。
(4)第3周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填图中的序号)。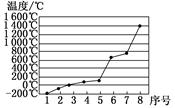
(5分) 1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图5,呈V型,键角116.5℃。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子。请回答:
图5 O3的分子结构
(1)臭氧与氧气的关系是___________。
(2)选出下列分子与O3分子的结构最相似的的是。
| A.H2O | B.CO2 | C.SO2 | D.BeCl2 |
(3)分子中某原子有1对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有______对孤对电子。
(4)O3分子是否为极性分子___________(是或否)。
(5)O3与O2间的转化是否为氧化还原反应___________
(5分)二氧化硅晶体中,每个硅原子周围有个氧原子,每个氧原子周围有个硅原子,硅氧原子个数比为。若去掉二氧化硅晶体中的氧原子,且把硅原子看作碳原子,则所得到空间网状结构与金刚石空间网状结构相同,试推测每个硅原子与它周围的4个硅原子所形成的空间结构为型;并推算二氧化硅晶体中最小的硅氧原子环上共有个原子
下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。
(1)单质B的化学式是,单质F的化学式是________ ,写出物质A的一种用途。
(2)写出单质B与强碱溶液反应的离子方程式,写出由沉淀J生成 H溶液的离子方程式,
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式,白色沉淀L会迅速变为色,最终变为红褐色沉淀G,写出L变为G的化学反应方程式。
(4)溶液I中所含金属离子是_____________________。
实验室盛放氢氧化钠溶液的试剂瓶不用玻璃塞,是因为玻璃中含有(填化学式),刻蚀玻璃常用的试剂是(填化学式),发生反应的化学方程式为,传统陶瓷的主要成分是类物质。