一包质量为23.24g的粉末,它是由NaCl、CuSO4、Na2O2、K2CO3、(NH4)2SO4、Na2SO4、KNO3等7种物质中的某几种混合而成。为测定其组成,进行以下实验:
(1)将粉末全部投入到足量蒸馏水中,得无色溶液与气体,加热使反应完全,共收集到气体3.36L(标准状况);
(2)将所得溶液分成两等份,一份加入酚酞溶液呈红色,用浓度为4mol·L–1的盐酸中和,用去该盐酸12.5mL;
(3)将另一份用稀硝酸酸化,无气体产生,再加过量的Ba(NO3)2溶液,得白色沉淀,质量为12.815g,滤液中加入AgNO3溶液,无可见现象;
(4)所得3.36L气体通过浓硫酸,气体体积明显减少,再通过碱石灰,气体体积不变。
试根据以上实验现象判断、计算、得出结论。(将结论填入下边,有几种物质填几空)
| 粉末组成物质分别是 |
|
|
|
|
|
|
| 质量为(g) |
|
|
|
|
|
|
已知下列反应:
①2C(s)+O2(g)=2CO(g)△H1 =" –221" kJ/mol
②CO(g)+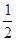 O2(g)=CO2 (g)△H2 =" –283" kJ/mol
O2(g)=CO2 (g)△H2 =" –283" kJ/mol
③ 稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H3 =" –57.3" kJ/mol
请回答下列问题:
(1)碳(C)的燃烧热为。
已知碳的两种同素异形体的转化:C(s,金刚石) = C(s,石墨) △H =" –1.9" kJ/mol
则从能量角度判断:稳定性更大的是(填名称)
(2)写出能表达反应③意义的一个热化学方程式
若稀醋酸与氢氧化钠稀溶液恰好反应的中和热为△H4,则△H3△H4(填“>”,“=”或“<”)
(1)质量相同的O2、NH3、H2、Cl2四种气体中,在相同温度和相同压强条件下,体积最大的是。
(2)下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是。(填序号)
①NaAlO2②Ca(OH)2③Na2CO3④Al(OH)3⑤NaHCO3⑥Si
(3)氯水中含有多种成分。将紫色石蕊试液滴入氯水中,溶液显红色起作用的成分是;过一会儿,溶液颜色逐渐褪去,起作用的成分是;
(4)已知:Fe2+的还原性强于Br—,标准状况下把11.2L氯气通入500ml 0.8mol/L FeBr2溶液中,写出反应完全后的离子方程式。
近年来,我国对储氢纳米碳管的研究获得了重大进展,电弧法合成的纳米碳管常伴有大量物质——碳纳米颗粒。这种碳纳米颗粒可用氧化法提纯。其反应的化学方程式为:
C + K2Cr2O7+ H2SO4(稀)—— CO2+ K2SO4+ Cr2(SO4)3+
(1)配平、完成上述反应的化学方程式,并用“单线桥法”表示电子转移情况。
(2)此反应的氧化剂是,上述反应中若产生11g气体物质,则转移的电子数为。
(3)H2SO4在上述反应中表现出来的性质是
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1)人们利用CO能与金属镍反应,生成四羰基镍,然后将四羰基镍分解从而实现镍的提纯,最后可以得到纯度达99.9%的高纯镍。具体反应为:
该正反应的ΔH 0(选填“>”或“=”或“<”)。
(2)工业上可利用CO生产乙醇:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)="==" H2O(g) ΔH2
CO(g)+H2O(g) CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________。
(3)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:
4H2(g)+2CO(g) CH3OCH3(g)+H2O(g),
CH3OCH3(g)+H2O(g),
下列选项能判断该反应达到平衡状态的依据的有___。
A.2v(H2)= v(CO)
B.CO的消耗速率等于CH3OCH3的生成速率
C.容器内的压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(4)工业可采用CO与H2反应合成再生能源甲醇,反应:CO(g)+ 2H2(g) CH3OH(g)
CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图28题-1)所示。
①合成甲醇的反应为____(填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为___。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为____L。
④(题28-图2)中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图.当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图.
⑤CO的平衡转化率(α)与温度(T)、压强(p)的关系如(题28 -图3)所示,实际生产时条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是________。
(本题共2小题,共18分)Ⅰ.A、B、C、D、E、X是中学常见的无机物,存在下图所示转化关系(部分生成物和反应条件略去);已知A由短周期非金属元素组成,B具有漂白性且光照易分解。
(1)若A为单质,且常温下0.1 mol·L-1C溶液的pH为1,请回答以下问题:
①组成单质A的元素在元素周期表中的位置为;
②A与H2O反应的离子反应方程式为.
③X可能为(填代号).
a.NaOHb.AlCl3c.Na2CO3d.NaAlO2
(2)若A为两种元素形成的化合物,且E与水反应生成G的浓溶液遇C有白烟产生则:
①A的电子式为.
②A与H2O反应的化学反应方程式为.
Ⅱ.某化合物A是一种易溶于水的不含结晶水盐,溶于水后可完全电离出三种中学化学常见离子,其中有两种是10电子的阳离子。用A进行如下实验:取2.370gA溶于蒸馏水配成溶液;向该溶液中逐滴加入一定量的氢氧化钠溶液,过程中先观察到产生白色沉淀B,后产生能使湿润红色石蕊试纸变蓝的气体C,气体不再产生时沉淀开始溶解,当沉淀恰好完全溶解时共用去氢氧化钠的物质的量为0.050mol。回答下列问题:
(1)请画出沉淀B中金属元素的原子结构示意图。
(2)化合物A的化学式为;
请设计实验方案验证A中阴离子;
(3)请写出沉淀B溶解在氢氧化钠溶液中的离子方程式.
(4)请写出气体C与氯气发生氧化还原反应的化学方程式.