某化学反应2A (g) ≒ B(g) + D(g) 在4种不同条件下进行,B和D的起始浓度为0 ,反应物A 的浓度(mol•L-1) 随反应时间 (min) 的变化情况如下表:
| 实验 序号 |
 浓度 浓度时间 温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.5 0 0 |
0.50 |
| 2 |
800℃ |
1.0 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)实验1达到平衡的时间是 min,实验4达到平衡的时间是 min,C3 1.0 mol•L-1(填“< ”、“ > ”或“ = ” )。
(2)实验4比实验1的反应速率 (填“快”或“慢”),原因是 。
(3)如果2A (g) ≒ B(g) + D(g) 是一个放热反应,那么实验4与实验1相比, 放出的热量多,理由是 。
已知: ① 2FeCl3 + 2KI ="=" 2FeCl2 + 2KCl + I2,② 2FeCl2+Cl2 ="==" 2FeCl3
根据①②两式判断各物质的氧化性由强到弱的顺序。
| A.FeCl3 > Cl2 > I2 | B.Cl2 > FeCl3 > I2 | C.I2> Cl2 > FeCl3 | D.Cl2> I2> FeCl3 |
现有以下物质: ①NaCl溶液②CO2③H2SO4④Cu⑤HNO3⑥蔗糖⑦酒精⑧ HCl ,其中属于电解质的是:(填序号,下同);属于非电解质的是:;属于一元酸的是:。
① HNO3的摩尔质量是_______,0.5mol HNO3的质量是,1.5mol HNO3含有_____mol氧原子。
② 标准状况下11.2L CO2的物质的量是。
孔雀石主要含Cu2(OH)2CO3,还含少量杂质FeO、Fe2O3、SiO2。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:



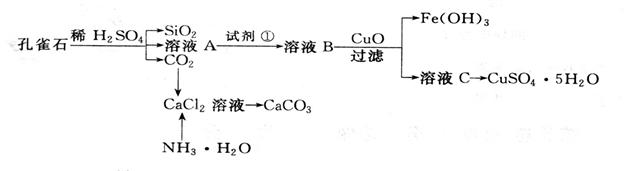

 请回答下列问题:
请回答下列问题: (1)溶液A的金属离子有__________。检验溶液A中Fe3+的最佳试剂为
(1)溶液A的金属离子有__________。检验溶液A中Fe3+的最佳试剂为  A、KMnO4 B、(NH4) 2S C、H2O2 D、KSCN
A、KMnO4 B、(NH4) 2S C、H2O2 D、KSCN  (2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。 (3)制备CaCO3时,应向CaCl2溶液中先加入NH3.H2O,然后通入CO2,反应的方程式:__________________________________________________________________。
(3)制备CaCO3时,应向CaCl2溶液中先加入NH3.H2O,然后通入CO2,反应的方程式:__________________________________________________________________。


 (4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
(5)探究氧化铜的性质:取A、B两支试管,往A中加入适量的CuO粉末,再分别向A和B加入等体积3% H2O2溶液,只观察到A中有大量气泡,结论是:。
在某个容积为2 L的密闭容器内,在T1℃时按下图1所示发生反应:
mA(g)+nB(g)  pD(g)+qE(s),DH<0(m、n、p、q为最简比例的整数)。
pD(g)+qE(s),DH<0(m、n、p、q为最简比例的整数)。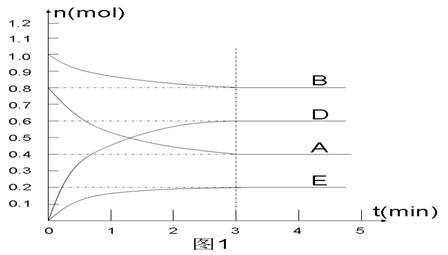
(1)据图1所示,反应开始至达到平衡时,用D表示该反应速率为_____________;
(2)该反应的化学平衡常数K的表达式为________________________________;
(3) 下列措施能增大B的转化率的是 ()
| A.升高温度 |
| B.保持体积不变通入1molB |
| C.保持体积不变移出部分物质D(g) |
| D.将容器的容积增大为原来2倍 |
E. 保持体积不变通入1mol A
(4) 反应开始时向容器中通入一定量的A和B,反应达到平衡时,测得D的浓度为0.6 mol.L-1。(图2中纵坐标为D的浓度)
①请用实线在下图坐标系中该表示平衡的建立过程。
②若该反应在T2℃(T2> T1)温度下进行,请用虚线画出该平衡的建立过程。