根据以下有关信息确定某有机物的组成:
(1)测定实验式:某含C、H、O三种元素的有机物,经燃烧实验测得其碳的质量分数为64.86%,氢的质量分数为13.51%,则其实验式是________。
(2)确定分子式:下图是该有机物的质谱图,则其相对分子质量为______,分子式为________。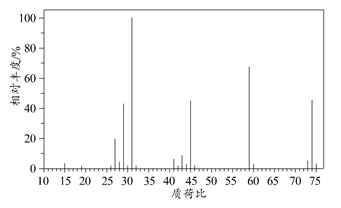
某无色透明溶液中可能大量存在OH-、Cl-、Na+、Mg2+、Cu2+中的几种离子。
(1)不做任何实验就可以肯定原溶液中不存在的离子是_______。
(2)取少量原溶液加入铝粉有气体放出,说明原溶液中肯定存在的离子是___________,有关的离子方程式为:____________________________。
(3)另取少量原溶液加入过量稀硝酸,再加几滴AgNO3溶液,出现白色沉淀,说明原溶液中肯定存在的离子有_________。
(4)原溶液中_________(填“肯定存在” 、“肯定不存在”或 “无法确定”) Na+。
(1)12.4gNa2X中含0.4mol Na+,则Na2X的摩尔质量是。
(2)将密度为1.84g/cm3、质量分数为98%的浓硫酸稀释成1000ml、物质的量浓度为2mol/L、密度为1.20g/cm3的稀硫酸。所需浓硫酸的体积为。
(一)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。下表为几种弱酸在25℃时的电离平衡常数
| 酸 |
电离平衡常数K |
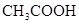 |
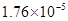 |
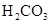 |
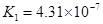 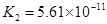 |
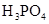 |
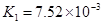 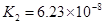 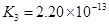 |
回答下列问题:
(1)K只与温度有关,当温度升高时,K值____(填“增大”、“减小”、“不变”)。
(2)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是_________,最弱的是________。
(3)对于同一种多元弱酸,有不止一个电离平衡常数,多个常数K1、K2、K3、之间存在某种大小关系,此关系是________________;以碳酸为例,用离子方程式和必要的文字说明产生此规律的原因_________________________。
(4)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的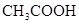 的电离转化率为____,则该温度下醋酸的电离平衡常数
的电离转化率为____,则该温度下醋酸的电离平衡常数 _____。
_____。
(二)化合物SOCl2是一种液态化合物,沸点77 ℃。在盛有10 mL水的锥形瓶中,小心地滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出。该气体可使滴有品红试液的滤纸褪色。
(1)写出SOCl2和水反应的化学方程式:_____________________________。
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是;用SOCl2与AlCl3·6H2O混合共热得到无水AlCl3,原因是________________________ 。
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)  CH3OH(g)下表为不同温度下的平衡常数(K)
CH3OH(g)下表为不同温度下的平衡常数(K)
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
(1)该反应的平衡常数表达式K=,ΔH0(填“>”、“<”或“=”)。
(2)将1 mol的H2和 1 mol 的 CO充入 1 L 恒容密闭反应器中,达到平衡后,容器内的压强为开始时的60%,求CO的平衡转化率(写出计算过程)。
(3)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是
(填字母)。
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡时c(H2)/ c(CH3OH)减小
(4)其他条件相同时,在上述三个温度下分别发生该反应。300℃时,H2的转化率随时间的变化如图所示,请补充完成350℃时H2的转化率随时间的变化示意图。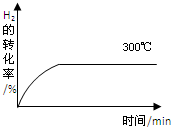
(16分)(一)某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,通过测定褪色所需时间来判断反应的快慢。限选试剂与仪器:0.20mol/LH2C2O4溶液,0.010mol/L 酸性KMnO4溶液,蒸馏水,锥形瓶,恒温水浴槽,量筒,秒表。该小组设计了如下的方案。
| 物理量 |
H2C2O4溶液 |
酸性KMnO4溶液 |
温度/℃ |
|||
| 浓度/mol·L-1 |
体积/mL |
浓度/mol·L-1 |
体积/mL |
|||
| ① |
0 |
0.20 |
2.0 |
0.010 |
4.0 |
50 |
| ② |
0 |
0.20 |
2.0 |
0.010 |
4.0 |
25 |
| ③ |
0.010 |
4.0 |
25 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:n(H2C2O4):n (KMnO4) ≥_______。
(2)请完成表格内五处空白。
(3)实验③测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=______________mol·L-1·min-1。
(4)已知50℃时c(MnO4—)~反应时间t的变化曲线如下图。其中反应速率最快的阶段是_____,原因是。 
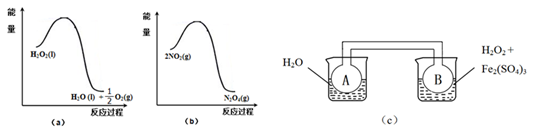
(二)利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是_________________________。