(一)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。下表为几种弱酸在25℃时的电离平衡常数
| 酸 |
电离平衡常数K |
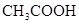 |
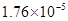 |
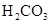 |
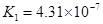 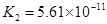 |
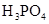 |
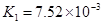 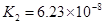 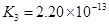 |
回答下列问题:
(1)K只与温度有关,当温度升高时,K值____(填“增大”、“减小”、“不变”)。
(2)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是_________,最弱的是________。
(3)对于同一种多元弱酸,有不止一个电离平衡常数,多个常数K1、K2、K3、之间存在某种大小关系,此关系是________________;以碳酸为例,用离子方程式和必要的文字说明产生此规律的原因_________________________。
(4)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的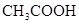 的电离转化率为____,则该温度下醋酸的电离平衡常数
的电离转化率为____,则该温度下醋酸的电离平衡常数 _____。
_____。
(二)化合物SOCl2是一种液态化合物,沸点77 ℃。在盛有10 mL水的锥形瓶中,小心地滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出。该气体可使滴有品红试液的滤纸褪色。
(1)写出SOCl2和水反应的化学方程式:_____________________________。
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是 ;用SOCl2与AlCl3·6H2O混合共热得到无水AlCl3,原因是________________________ 。
是自然界存在最广泛的
族元素,常以化合物
存在。从单质A起始发生的一系列化学反应可由下图表示: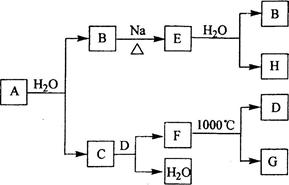
请回答下列问题:
(1)
与水反应的化学方程式为,
与水反应的化学方程式为;
(2)
的化学式为,
和
的电子式分别为;
(3)
与
反应可能生成的盐有(填化学式);
(4)实际生产中,可由
为原料制备单质
,简述一种制备方法。
高炉炼铁过程中发生的主要反应为
已知该反应在不同温度下的平衡 常数如下:
常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式
=,
0(填">"、"<"或"=");
(2)在一个容积为10
的密闭容器中,1000℃时加入
、
、
、
各1.0
,反应经过l0
后达到平衡。求该时间范围内反应的平均反应速率
=、
的平衡转化率=:
(3)欲提高(2)中
的平衡转化率,可采取的措施是。
A.减少 的量
B.增加 的量
C. 移出部分
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂
(I已知: ,如果要合成
,如果要合成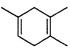 所用的原始原料可以是
所用的原始原料可以是
A. 2-甲基-l,3-丁二烯和2-丁炔 B.1,3-戊二烯和2-丁炔
C.2,3-二甲基-1,3-戊二烯和乙炔 D、2,3-二甲基-l,3-丁二烯和丙炔
II
都是有机化合物,它们的转化关系如下:
请回答下列问题:
(1)已知:6.0
化合物
完全燃烧生成8.8
和3.6
;
的蒸气与氢气的相对密度为30,则
的分子式为:
(2)
为一取代芳烃,
中含有一个甲基。由
生成
的化学方程式为;
(3)由
生成
、由
生成
的反应条件分别是、;
(4)由
生成
、由
生成
的反应类型分别是、;
(5) 存在于栀子香油中,其结构简式为;
存在于栀子香油中,其结构简式为;
(6)在
的同分异构体中,苯环上一硝化的产物只有一种的共有个,其中核磁共
振氢谱有两组峰,且峰面积比为l:1的是 (填结构简式)。
钒(
)及其化合物广泛应用于工业催化、新材料和新能源等领域.
(1)
是接触法制硫酸的催化剂.
①一定条件下,
与空气反映t
后,
和
物质的量浓度分别为
和
, 则
起始物质的量浓度为mol/L ;生成
的化学反应速率为
.
②工业制硫酸,尾气
用吸收.
(2)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如题29图所示.
①当左槽溶液逐渐由黄变蓝,其电极反应式为
②充电过程中,右槽溶液颜色逐渐由色变为色.
③放电过程中氢离子的作用是和;充电时若转移的电子数为3.01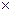 1023个,左槽溶液中
的变化量为.
1023个,左槽溶液中
的变化量为.
阻垢剂可防止工业用水过程中无机物沉积结垢,经由下列反应路线可得到
和
两种阻垢剂(部分反应条件略去).
(1)阻垢剂E的制备
①
可由人类重要的营养物质水解制得(填"糖类"、"油脂"或"蛋白质").
②
与新制的
反应生成
,其化学方程式为.
③
经加聚反应生成
,
的结构简式为.
(2)阻垢剂
的制备

①
为取代反应,
的结构简式为.
②
转化为
的过程中,
分子中增加的碳原子来源于.
③由
制备
的反应步骤依次为:
![]() 、、(用化学方程式表示).
、、(用化学方程式表示).
④1
的同分异构体
(碳链无支链)与足量
溶液作用产生2
,
的结构简式为(只写一种).