氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H—H键能为4 36kJ·mol—1,
36kJ·mol—1, 键能为945kJ· mol—1,N—H键能为391kJ·mol—1。写出合成氨反应的热化学方程式:
键能为945kJ· mol—1,N—H键能为391kJ·mol—1。写出合成氨反应的热化学方程式:
用下图所示的装置进行电解,通电一会儿,发现湿润的淀粉-KI试纸的C端变蓝色,则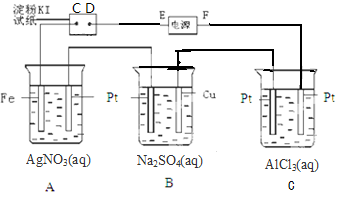
(1)E为极,A中Pt电极上得电极反应方程式为____
C中发生反应的化学方程式为_____
(2)在B中出现的现象是_____,,。
(3)室温下,若从电解开始到时间t s,A、B装置中共收集到气体0.168L(标准状况下).若电解过程中无其他副反应发生,经测定电解后A中溶液体积恰好为1000mL,则A溶液中pH为.
非金属元素H、C、N、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛,完成下列各题。
(1)①O2-的核外电子排布式为,CS2的晶体类型为晶体,其C的轨道杂化方式为;
②CH3OH在常温下为液态,沸点高于乙烷的主要原因是;
(2)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
| 危险性 |
 |
| 储运要求 |
远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 |
NaOH、NaHSO3溶液吸收 |
| 包装 |
钢瓶 |
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用。
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是。
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3。当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于
(3)室温时,向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。分析图中a、b、c、d四个点,水的电离程度最大的是;在b点,溶液中各离子浓度由大到小的排列顺序是。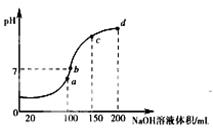
0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol。
(1)烃A的分子式为;
(2)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代产物只有一种,则A 的结构简式为;
(3)若烃A能使溴水褪色,在催化剂作用下,与H2发生加成反应,其加成产物B经测定分子中含有4个甲基,且其核磁共振氢谱图中有两组峰,则A可能的结构简式为,B的名称为。
在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图。回答下列问题:
(1)该反应的化学方程式为。
(2)0~t1 s内A气体的反应速率为。
(3)反应后与反应前的压强之比为。
(4)(t1+10)s时,A气体的体积分数为,此时v(A)正v(B)逆(填“>”、“<”或“=”)。
(5)关于该反应的说法正确的是 。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
(1)下列7种固态物质:
| A.P4 |
| B.SiO2 |
| C.NH4Cl |
| D.Ca(OH)2 |
E.NaF
F.CO2(干冰)
G.金刚石
回答下列问题(填字母代号):
①既有离子键又有共价键的是。
②熔化时不需要破坏化学键的是,熔化时需要破坏共价键的是。
(2)某元素最高正化合价为+6,其最低负价为。某元素R与氢形成的气态氢化物的化学式为RH3,其最高价氧化物的化学式为。