在上海召开的第七届全球人类基因大会上,我国科学家第一次提出可以用砒霜(As2O3)来治疗早期幼粒白血病。(本题共7分)
(1)完成并配平下列化学方程式:
As2O3+ Zn+ H2SO4 → AsH3+ ZnSO4+ ______
(2)As2O3在上述反应中显示出来的性质是_____________。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
(3)若生成0.1 mol AsH3,则转移电子的物质的量为___________mol。
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。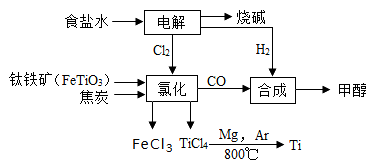
请回答下列问题:
(1)Fe位于元素周期表中第________________周期,第_______________族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| TiCl4 |
Mg |
MgCl2 |
Ti |
|
| 熔点/℃ |
-25.0 |
648.8 |
714 |
1667 |
| 沸点/℃ |
136.4 |
1090 |
1412 |
3287 |
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为___________________。(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
Ⅰ.氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它。CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+===Cu2++Cu.根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作______________(填“氧化剂”或“还原剂”).
(2)写出CuH在氯气中燃烧的化学反应方程式:________________________
(3)CuH溶解在稀盐酸中生成的气体是_______________(填化学式).
(4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:__________________________
Ⅱ.某强酸性反应体系中,反应物和生成物共六种物质:PbO2、PbSO4(难溶盐)、Pb(MnO4)2(强电解质)、H2O、X(水溶液呈无色)、H2SO4,已知X是一种盐,且0.1 mol X在该反应中失去3.01×1023个电子。
(1)写出该反应的化学方程式:_____________________________________;
(2)若有9.8 g H2SO4参加反应,则转移电子的物质的量为______________;
(3)本反应体系中,若用浓盐酸代替硫酸,用离子方程式表示后果:___________________。
分,每空有四瓶失去标签的溶液A、B、C、D,它们可能分别是硫酸、盐酸、碳酸钠和硝酸钾溶液中的某一种。各取少量分别放入四支试管里,先向各试管中滴加BaCl2溶液,则A、B有白色沉淀,C、D无明显现象,再向A、B白色沉淀中加入稀硝酸,则A试管中白色沉淀溶解,并有无色气体产生,B试管无变化。另取C、D各少量,分别加入AgNO3溶液,则C试管有白色沉淀,D试管无变化。由此判断:(填化学式)
A. B. C. D.
(Ⅰ)在标准状况下,体积为8.96 L的CO和CO2的混合气体共14.4 g。
(1)CO的质量为______________g。
(2)CO的体积为______________L。
(3)混合气体的平均摩尔质量为____________g·mol-1。
(4)混合气体的密度为____________g·L-1。(小数点后保留1位)
(Ⅱ)现要配制1 mol·L-1 Na2CO3溶液250mL,求:
①需要固体Na2CO3____________g;
②需要含结晶水的碳酸钠晶体(Na2CO3·10H2O)____________g;
③需要物质的量浓度为4 mol·L-1的Na2CO3溶液____________mL;
某温度(T ℃)下的溶液中,c(H+)=10-x mol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示,请回答下列问题:
(1)此温度下,水的离子积Kw为______________,则该温度T_____________25(填“>”、“<或“=”)。
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
| 实验序号 |
Ba(OH)2溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
| ① |
22.00 |
0.00 |
8 |
| ② |
22.00 |
18.00 |
7 |
| ③ |
22.00 |
22.00 |
6 |
假设溶液混合前后的体积变化忽略不计,则a=_____________________,实验②中由水电离产生的c(OH-)=________________mol·L-1。
(3)在此温度下,将0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
| 甲 |
乙 |
丙 |
丁 |
|
| 0.1 mol·L-1 Ba(OH)2溶液体积/mL |
10 |
10 |
10 |
10 |
| 0.1 mol·L-1 NaHSO4溶液体积/mL |
5 |
10 |
15 |
20 |
①按丁方式混合后,所得溶液显________________(填“酸”、“碱”或“中”)性。
②写出按乙方式混合后,反应的离子方程式:_________________________。
③按甲方式混合后,所得溶液的pH为______________________。