(6分) 酸性KMnO4、H2O2、NaClO在生产、生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸 (H2C2O4 )去除Fe(NO3)3也是重要氧化试剂,下面是对这三种氧化剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的化学方程式并用双线桥法在化学方程式上标出电子转移的方向和总数____________________。
(2)取300 mL 0.2 mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是________mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。写出溶液先变为浅绿色的离子方程式_________________________________。
以下是化合物J的合成路线流程图: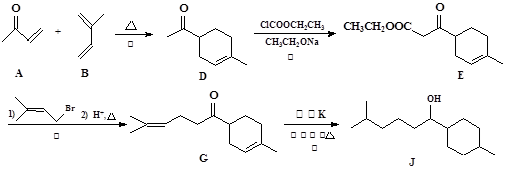
(1)反应①②③④中属于加成反应的是(填序号)。
(2)化合物E的含氧官能团为和(填官能团的名称)。
(3)请写出D转化为E的化学方程式___________________________________________
(4)实现G→J的转化中,加入的物质K是_____________。
(5)A+B→D的反应中还能生成D的一种同分异构体,请写出该同分异构体的结构简式________________________。
(6)请写出以2-甲基-2-溴丁烷为原料制备化合物B的合成路线流程图(无机试剂任用)。合成路线流程图如题中所示。
_________________________________________________________________________
(1)分子式为C5H12O属于醇且能催化氧化生成醛的有机物有种;
(2) 与NaOH水溶液共热,生成的有机物的结构简式为________;
与NaOH水溶液共热,生成的有机物的结构简式为________;
(3)某有机物的分子式为C6H12,若其分子中所有碳原子一定处于同一平面,则该有机物的结构简式为_______________;若该有机物有一个反式异构体,且能与氢气加成生成2-甲基戊烷,则该有机物的结构简式为_______________;
(4)有机物C6H5C≡CCH2CBr3分子中,在同一条直线上的原子最多有__________个;
(5)在澄清的苯酚钠溶液中通入CO2气体,溶液浑浊,其反应方程式是:
________________________________________________________________________。
现有九种有机物:①甲烷 ②溴乙烷 ③乙炔 ④丙三醇⑤ ⑥苯 ⑦甲苯 ⑧乙烯 ⑨乙醇
⑥苯 ⑦甲苯 ⑧乙烯 ⑨乙醇
(1)将序号填入下列相应的空格中:
日常生活中作燃料的是___________(至少写一种);作为制取炸药原料的是________(至少写一种);常温下能与溴水发生加成反应的是_______________;常温下呈液态,能作溴水的萃取剂,也能使酸性高锰酸钾溶液褪色的是____________;互为同系物的是_______________。
(2)⑤号物质的名称是___________________。
(3)请完成以下方程式
②→⑧__________________________________________________________________;
⑨→②__________________________________________________________________。
实验室制取③的反应______________________________________________________。
有机物A、B、C、D有如下转化关系。回答下列问题:
(1)乙烯的电子式为 ,分子中含有的共价键类型有(填极性键或非极性键)。C中含官能团名称;
(2)写出反应的化学方程式和有机反应类型:
④,反应类型:。
⑤,反应类型: 。
(3)反应②和反应③都可以用来制备物质B,反应②的条件为。若要制取物质B,最好采用反应(选填②或③),原因是。
(4)某单烯烃通过加成反应得到的某烷烃的相对分子质量为86,则该烯烃的分子式为_________。该烷烃存在多种同分异构体,请写出只能由一种烯烃加成得到的烷烃的结构简式,并用系统命名法命名:、。
已知在容积固定的密闭容器中充入NH3和O2发生如下反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
(1)下列能说明该反应已经达到平衡状态的是;
A.容器中气体总质量不变
B.c(O2)不变
C.υ(O2)=1.25υ(NH3)
D.体系压强不变
E.相同时间内,消耗0.1 mol NH3,同时消耗了0.1 mol NO
(2)向该容器中加入正催化剂,则反应速率(选填“增大”、“减小”、“不变”,下同),降低容器的温度则反应速率,通入Ar,则反应速率。
(3)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小,其原因是。
A.反应体系温度先升高后降低,所以反应速率是先增大后减小
B.反应物浓度先升高后降低,所以反应速率先增大后减小
C.该反应为放热反应,在反应开始阶段,主要受体系温度升高的影响,反应速率增大;在反应后阶段,主要受浓度减小因素的影响,反应速率减慢