将2mol X和1mol Y的混合气体置于等压密闭容器中,此时容器的体积为120 L,在一定温度下发生反应:2X(g)+Y(g) 2Z(g)。当反应达到平衡状态A时,测得气体的密度变为反应前的1.2倍。请回答下列问题:
2Z(g)。当反应达到平衡状态A时,测得气体的密度变为反应前的1.2倍。请回答下列问题:
(1)达平衡状态A时,Y的转化率为________,容器的体积为_________;在达到平衡状态A的容器中通人少量Y,体系中X的体积分数将_______(填“增大”或“减小”或“不变”)。
(2)若在同一容器中起始加入X、Y、Z分别为a、b、c mol,达到 平衡后Y的体积分数与平衡状态A相同,则起始时a、b、c应满足的关系为___________.___________。
平衡后Y的体积分数与平衡状态A相同,则起始时a、b、c应满足的关系为___________.___________。
(3)若反应在一体积为120 L的等容密闭容器中进行,要使平衡后各气体体积分数与平衡状态A相同,则起始时应加入X:_________mol,Y:_________mol,Z:0 mol。
有V、W、X、Y、Z五种元素,它们的核电荷数依次增大;且都小于20。其中只有X、Z是金属元素;V、Z元素原子最外层都只有一个电子;W、Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半.由此推知:
V是、W是、X是、Y是、Z是(填元素符号)
请将5种物质:N2O、FeCl2、Fe(NO3)3、HNO3和FeCl3分别填入下面对应的横线上,组成一个未配平的化学方程式。
(1)+→+++H2O(不需配平)
(2)反应过程中,N2O与FeCl2的物质的量之比为。
不同金属离子在溶液中完全沉淀时,溶液的pH不同。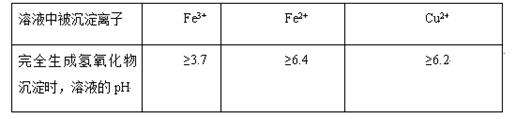
氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。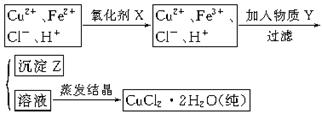
(1)下列氧化剂中适合作氧化剂X的是(填序号);
| A.NaClO | B.H2O2 | C.KMnO4 | D.Cl2 |
(2)物质Y的化学式是、;(任写两种)
(3)写出从(2)题任选一个物质Y参与反应生成沉淀Z离子方程式:。
(4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?(填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作?。
(5)氢氧化铜常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于。
根据下列流程回答: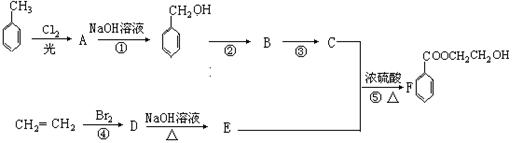
(1)写出C、E中含氧官能团的名称分别为: 、。
(2)写出结构简式 A E
(3)在①~⑤反应中,属于取代反应的是(填编号)。
(4)写出有关⑤的化学方程式:
在50 mL a mol·L-1的硝酸溶液中,加入6.4 g Cu,固体全部溶解,且还原产物只有NO2和NO。将反应后溶液用蒸馏水稀释至100 mL,测得c(NO3-)=4 mol·L-1。
(1)稀释后的溶液中c(H+)=mol·L-1
(2)若a=10,则生成的气体中NO2的物质的量为________mol
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO2+NaNO3+H2O
若上述混合气体被1 mol·L-1的NaOH溶液恰好吸收,则NaOH溶液的体积为________mL