在一定条件下,将钠与氧气反应的生成物1.5g溶于水,所得溶液恰好能被80mL浓度为0.50mol/L的HCl溶液中和,则该生成物的成分是( )
| A. Na2O | B. Na2O2 | C. Na2O和Na2O2 | D. Na2O2和NaO2 |
已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1)△H="―Q1" KJ/mol 2H2(g)+O2(g)==2H2O(g) △H=―Q2 KJ/mol 2H2(g)+O2(g)==2H2O(1) △H = ―Q3KJ/mol常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为多少KJ()
| A.0.4Q1+0.1Q2 | B.0.4Q1+0.05Q2 | C.0.4Q1+0.1Q3 | D.0.4Q1+0.05Q3 |
碳酸铵((NH4)2CO3)在室温下就能自发地分解产生氨气,对其说法中正确的是( )
)
| A.其分解是因为生成了易挥发的气体,使体系的熵增大 | B.其分解是因为外界给予了能量 |
| C.其分解是吸热反应,据能量判据不能自发分解 | D.碳酸盐都不稳定,都能自发分解 |
下列关于铜电极的叙述,正确的是()
| A.铜锌原电池中铜是正极 |
| B.用电解法精炼粗铜时铜作阳极 |
| C.在镀件上电镀铜时可用金属铜作阳极 |
| D.电解稀硫酸制H2、O2时铜作阳极 |
下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是()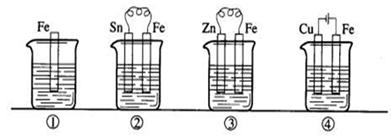
| A.④>②>①>③ | B.②>①>③>④ |
| C.④>②>③>① | D.③>②>④>① |
下列说法正确的是 ( )
(1)增加水的量或温度,可以加快镁跟水的反应速率。
(2)增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率
(3)对于反应CaCO3(s)  CaO(s) + CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
CaO(s) + CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
(4)对反应3H2(g) + N2(g)  2NH3(g),在密闭容器中进行(固定体积),充入氦气,压强增大,则化学反应速率加快
2NH3(g),在密闭容器中进行(固定体积),充入氦气,压强增大,则化学反应速率加快
(5)对于反应3H2(g) + N2(g)  2NH3(g),使用正催化剂,正逆反应速率同等程度加快。
2NH3(g),使用正催化剂,正逆反应速率同等程度加快。
| A.(1) (2) | B.(1) (2) (3) | C.(1) (2) (3) (4) | D.(5) |