制备溴苯的实验装置如右图所示,回答下列问题:
(1)反应开始前已向仪器A中加入的药品是 。
装在左侧分液漏斗中的药品是 。
(2)将左侧分液漏斗的旋纽打开后,在A中可观察到的现
象是 。
(3)冷凝管B有上、下两口,冷却水应从 口进入。
(4)右侧分液漏斗中的物质在什么时间加入A中?
。其作用是 。
(5)要证明该反应是取代反应,最方便的实验方法是 。
(1)元素的第一电离能:
(填">"或"<")。
(2)基态
的核外电子排布式为。
(3)硅烷(
)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是。
(4)硼砂是含结晶水的四硼酸钠,其阴离子
(含
三种元素)的球棍模型如图所示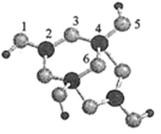
①在
中,硼原子轨道的杂化类型有;配位键存在于原子之间(填原子的数字标号);
=(填数字)。
②硼砂晶体由
、
和
构成,它们之间的作用力有(填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(1)电镀时,镀件与电源的极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层。
① 若用铜盐进行化学镀铜,应选用(填"氧化剂"或"还原剂")与之反应。
② 某化学镀铜的反应速率随镀液pH 变化如右图所示。该镀铜过程中,镀液pH 控制在12.5左右。据图中信息,给出使反应停止的方法:

(3)酸浸法制取硫酸铜的流程示意图如下

① 步骤(i)中
发生反应的化学方程式为。
② 步骤(ii)所加试剂起调节
作用的离子是(填离子符号)。
③ 在步骤(iii)发生的反应中,1 mol
转移2 mol 电子,该反应的离子方程式为。
④ 步骤(iv)除去杂质的化学方程式可表示为:
过滤后母液的 , , , ,该反应的平衡常数K=(用含a 、b 、d 的代数式表示)。
(1)元素
的离子与
所含电子数和质子数均相同,则
的原子结构示意图为。
(2)硫酸铝溶液与过量氨水反应的离子方程式为。
(3)能证明
溶液中存在
 水解平衡的事实是(填序号)。
水解平衡的事实是(填序号)。
A.滴人酚酞溶液变红,再加人
溶液后红色退去
B.滴人酚酞溶液变红,再加人氯水后红色退去
C.滴人酚酞溶液变红,再加人
溶液后产生沉淀且红色退去
(4)元素
、
在周期表中位于向一主族,化合物
和
可发生如下转化(其中
是纤维素水解的最终产物):
① 非金属性
(填">"或"<")
②
与过量浓硝酸反应有红棕色气体生成,化学方程式为
(5)在恒容绝热(不与外界交换能量)条件下
 反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系:
反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系:
| 物质 |
||||
| 起始投料/ | 2 |
1 |
2 |
0 |
直接排放煤燃烧产生的烟气会引起严重的环境问题,将烟气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,最终生成硫酸钙。硫酸钙可在下图所示的循环燃烧装置的燃料反应器中与甲烷反应,气体产物分离出水后得到几乎不含杂质的二氧化碳,从而有利于二氧化碳的回收利用,达到减少碳排放的目的。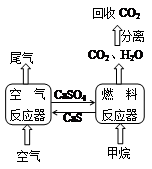
请回答下列问题:
(1)煤燃烧产生的烟气直接排放到空气中,引发的主要环境问题有。(填写字母编号)
| A. | 温室效应 | B. | 酸雨 | C. | 粉尘污染 | D. | 水体富营养化 |
(2)在烟气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间二氧化碳以增加其脱硫效率;脱硫时控制浆液的
值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。
①二氧化碳与石灰石浆液反应得到的产物为。
②亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为。
(3)已知1mol
在燃料反应器中完全反应生成气态水时吸收160.1
,1
在氧气中完全燃烧生成气态水时放热802.3
。写出空气反应器中发生的热化学方程式:。
(4)回收的
与苯酚钠在一定条件反应生成有机物M,其化学式为
,
经稀硫酸酸化后得到一种药物中间体
,N的结构简式为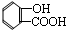 。
。
①M的结构简式为。
②分子中无
,醛基与苯环直接相连的N的同分异构体共有种。
下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去)。已知
为气态单质,
是地壳中含量最多的金属元素的单质,
为氧化物,
为黑色固体,
为红棕色气体,
为红褐色沉淀。
请回答下列问题:
(1)
中所含元素位于周期表中第周期族。
(2)
在
中燃烧的现象是。
(3)
的反应中,被氧化与被还原的物质的量之比是。
(4)
的离子方程式是。
(5)
受热分解的化学方程式是。