将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g) +B(g) 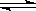 2C(g)+2D(g)△H<0,反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
2C(g)+2D(g)△H<0,反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s内正反应的平均反应速率为: ;
(2)反应前A的物质的量浓度是: ;
(3)10s末,生成物D的浓度为 ;
(4)平衡后,若改变下列条件,生成D的速率如何变化(用“增大”、“减小”或 “不变”填空)。
| 编号 |
改变的条件 |
生成D的速率 |
| ① |
降低温度 |
|
| ② |
增大A的浓度 |
|
| ③ |
使用催化剂 |
|
| ④ |
恒容下冲入Ne(不参与体系反应) |
|
氢气是一种清洁、高效的新型能源。
I.用甲烷制取氢气的反应分为两步,其能量变化如下图所示:
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是。
II.在容积为1L的密闭容器内,加入0.1molCO和0.1molH2O,在催化剂存在的条件下高温加热使其反应。测得CO2的浓度随时间变化的图像如下图:
(2)在该温度下,从反应开始至达到平衡时,CO的平均反应速率为;
(3)下列改变中,能使平衡向正反应方向移动的是。
| A.升高温度 | B.增大压强 |
| C.增大H2O(g)的浓度 | D.减少CO2(g)的浓度 |
(4)保持温度不变,若起始时c(CO)=1mol·L—1, c(H2O)="2" mol·L—1,反应进行一段时间后,测得H2的浓度为0.4 mol·L—1。通过计算,判断此时该反应进行的方向并说明理由:。
用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
(1)图中a极要连接电源的(填“正”或“负”)________极,C口流出的物质是________。
(2) 放电的电极反应式为____________。
放电的电极反应式为____________。
(3)电解过程中阴极区碱性明显增强,用平衡移动原理解释原因________。
进入秋冬季节后,郑州市频现雾霾天气,给人们的出行带来极大的不便和危害,人们“谈霾色变”。目前郑州市汽车保有量达230万量,汽车尾气的污染是引起雾霾的主要因素之一,NO和CO是汽车尾气的主要污染物。
(1)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g) SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1molSO2的同时生成1molNO
(2)气缸中生成NO的反应为:N2(g)+O2(g)=2NO(g)△H>0,汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是。假设空气中N2和O2的体积比为4︰1,1300℃时,1mol空气在某密闭容器内反应达到平衡时,测得NO为8×10-4mol,该反应的平衡常数K≈。
(3)汽车燃油不完全燃烧时生成CO,有人设想按下列反应除去CO:2CO(g)=C(s)+O2(g) △H>0,该设想能否实现?(填“能”或“不能”),原因是。
(4)在汽车尾气系统中安装催化转化器可减少CO和NO的污染,用化学方程式表示其原理:。
(5)某科研机构设计传感器检测CO的含量,其工作原理示意图如下: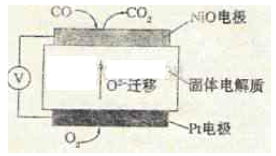
Pt电极上发生的是反应(填“氧化”或“还原”);
写出NiO电极的电极反应式。
有难溶于水的粉末状固体样品,可能含有Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种,研究小组通过实验确定样品的成分.
【查阅资料知】① Cu2O + 2H+ =" Cu" + Cu2+ + H2O;
② 部分氢氧化物在溶液中沉淀的pH见下表:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀的pH |
1.8 |
6.3 |
5.2 |
| 完全沉淀的pH |
3.0 |
8.3 |
6.7 |
【注】金属离子的起始浓度为0.1 mol·L-1
【实验步骤】
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀.
请回答下列问题.
(1)Ⅰ中产生气体的离子方程式为.
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是.
(3)溶液C中除H+、Cu2+外一定还含有的阳离子是.
(4)Ⅳ中加NaClO的目的是.
(5)将Ⅳ中得到的溶液D电解,阳极的电极反应式为;若电路中有0.1mol电子通过,则理论上阴极质量增重g.
(6)由上述实验可以获得结论:原样品所有可能的成分组合为组合为
(用化学式表示).
二氧化钛是钛的重要化合物,钛白粉(纯净的二氧化钛)是一种折射率高、着色力和遮盖力强、化学性质稳定的白色颜料.从钛铁矿(主要成分FeTiO3,含Fe2O3、SiO2等杂质)制取二氧化钛,常用硫酸法,其流程如下:
(1)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,该反应的化学方程式为:.
(2)取少量浸取液,滴加KSCN溶液后呈血红色,说明溶液中存在离子(填写离子符号),检验溶液中还存在Fe2+的方法是(写明步骤、试剂和现象).
(3)浸取液与铁屑反应的离子方程式为;X(晶体)的化学式为.
(4)第③步反应化学方程式.