设NA为阿伏加德罗常数的值。下列说法正 确的是
确的是
| A.标准状况下,80gSO3所占的体积约为22.4L |
| B.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA |
| C.电解精炼铜时,当转移了2 mol电子时,阳极上溶解的铜原子数一定为NA |
| D.标准状况下11.2 L NH3溶于1 L水中,溶液中含N原子的微粒总数为0.5 NA |
下列说法正确的是
A.按系统命名法,化合物 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 |
| B.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 |
| C.苯和甲苯互为同系物,均能使KMnO4酸性溶液褪色 |
D.结构片段 的高聚物,其单体是苯酚和甲醛 的高聚物,其单体是苯酚和甲醛 |
氰酸铵(NH4OCN)与尿素[CO(NH2)2]
| A.都是共价化合物 | B.都是离子化合物 |
| C.互为同分异构体 | D.互为同素异形体 |
下列关于实验室制备乙酸乙酯和乙酸丁酯的描述正确的是
| A.均采用水浴加热 | B.制备乙酸丁酯时正丁醇过量 |
| C.均采用边反应边蒸馏的方法 | D.制备乙酸乙酯时乙醇过量 |
根据有机化合物的命名原则,下列命名正确的是
A. 3-甲基-1,3-丁二烯 3-甲基-1,3-丁二烯 |
B.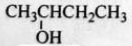 2-羟基丁烷 2-羟基丁烷 |
| C.CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |
| D.CH3CH(NH2)CH2COOH 3-氨基丁酸 |
下列烃在光照下与氯气反应,只生成一种一氯代物的有
| A.2-甲基丙烷 | B.环戊烷 |
| C.2,2-二甲基丁烷 | D.2,2-二甲基丙烷 |