向草酸(H2C2O4)溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色总是先慢后快。对其原因,某研究性学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验进行探究:
实验(1):在两支试管中分别加入10mL等浓度的草酸溶液,在②号试管中加入少量硫酸锰固体。然后在两支试管中分别加入5滴0.1 mol·L-1的硫酸酸化高锰酸钾溶液。现象如下(表1)
| |
①号试管 |
②号试管 |
| 加入药品 |
草酸溶液 硫酸酸化高锰酸钾溶液 |
草酸溶液 硫酸酸化高锰酸钾溶液 硫酸锰固体 |
| 实验现象(褪色时间) |
溶液褪色很慢(30s) |
溶液褪色很快(2s) |
实验(2):在两支试管中分别加入5 mL等浓度的草酸溶液,在②号试管中再滴加10滴稀硫酸,然后各加入5滴0.1 mol·L-1的高锰酸钾溶液。现象如下(表2)
| 编号 |
①号试管 |
②号试管 |
| 褪色时间 现象 |
100 s |
90 s |
| 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 |
实验(3):取3支试管分别加入5 mL等浓度草酸溶液,然后在①、②、③号试管中依次加入10滴、1 mL、2 mL稀硫酸溶液,各加入5滴0.1 mol·L-1的高锰酸钾溶液,然后置于温度为65℃的水浴中加热。观察现象(表3)。
| 编号 |
①号试管 |
②号试管 |
③号试管 |
| 褪色时间 实验现象 |
80 s |
100 s |
120 s |
| 均有气泡产生;①号试管的溶液褪色比②、③号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 |
(1)该研究性学习小组的实验目的是 。
(2)该研究性学习小组进行实验时所用的方法是科学实验中常用的一种方法,该方法叫 法;
(3)实验(1)得出的结论是 。
(4)由实验(2)和实验(3)得出的结论是(写三点)
_________________________,_____________________,_______________;
(5)据有关现象写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式:
H2C2O4+ MnO4—+ = Mn2++ + H2O
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如下图所示,请回答: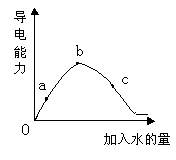
⑴“O”点导电能力为0的理由是:。
⑵a、b、c三点溶液中,[H+]由小到大的顺序是:。
⑶a、b、c三点溶液中,醋酸的电离程度最大的是:。
⑷若使c点溶液中[CH3COO-]增大,而[H+]减小,可采取的措施主要有:①;②;③;④。
Na、Mg、Al分别与盐酸反应。
(1)若盐酸足量,等物质的量的Na、Mg、Al产生的氢气质量之比为_______________。
(2)若盐酸足量,等质量的Na、Mg、Al产生H2的质量之比为_______________,溶液增重质量之比为_______________。
(3)若盐酸等质量且足量,充分反应后所得溶液质量相等,则Na、Mg、Al质量之比为_______________。
(4)若盐酸浓度相等,体积相等,投入的Na、Mg、Al质量相等,反应后有一种金属剩余,该金属是_______________。
(5)称取Na、Mg、Al各m g,在室温下分别与V L 4 mol·L-1的盐酸充分反应,试推断,在下列三种情况下,V的取值范围(用含m的表达式表示)。
①Al与盐酸反应放出H2最多时,______________。
②Na与盐酸反应放出H2最多时,______________。
③Mg和Al与盐酸反应产生H2一样多时,______________。
把11体积H2、5体积O2和1体积Cl2组成混合气体在密闭容器中引燃,恰好完全反应,所得盐酸的质量分数为_______________%。
配制500 mL 0.1 mol·L-1碳酸钠溶液:
(1)应该用托盘天平称取碳酸钠晶体(Na2CO3·10H2O)_______g。
(2)在称量碳酸钠晶体(Na2CO3·10H2O)时,一位同学将砝码与晶体位置放颠倒了(1 g以下使用游码),则平衡后实际称得的样品质量是_______。
配制500 mL 1 mol·L-1 NaCl溶液时,下列操作会使实验结果偏高的是______________,偏低的是______________,无影响的是______________。
| A.振荡、摇匀溶液后,发现液面低于刻度线,再补加水 |
| B.称量时,固体放在右盘,砝码放在左盘(未用游码) |
| C.原容量瓶洗涤后未干燥 |
| D.移液时,未洗涤烧杯和玻璃棒 |
E.定容时,俯视刻度线