设水的电离平衡线如右图所示。 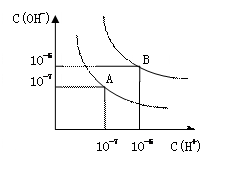
(1)若以A点表示25℃时水在电离平衡时的粒子浓度,当温
度升高到100℃时,水的电离平衡状态到B点,则此时水的离子
积从___________增加到____________; A
(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持
在100℃的恒温,欲使混合溶液的PH=7,则Ba(OH)2溶液和盐
酸的体积比为__________。
某无色溶液中只含有下列8种离子中的某几种:Mg2+、H+、Ag+、Na+、Cl-、HC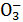 、OH-、N
、OH-、N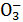 ,已知该溶液能与铝反应放出氢气。试回答下列问题:
,已知该溶液能与铝反应放出氢气。试回答下列问题:
(1)若反应后生成Al3+,则溶液中可能存在的离子有 ,一定存在的离子有 ,一定不存在的离子有 ,反应的离子方程式为 。
(2)若反应后生成Al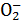 ,则溶液中可能存在的离子有 ,一定存在的离子有 ,一定不存在的离子有 ,反应的离子方程式为 。
,则溶液中可能存在的离子有 ,一定存在的离子有 ,一定不存在的离子有 ,反应的离子方程式为 。
金属镁的制取主要有两种途径,大约60%的镁是从海水中提取的,其余来自于含镁丰富的矿石,比如菱镁矿(主要成分为MgCO3)。从不同途径获得镁的流程如下: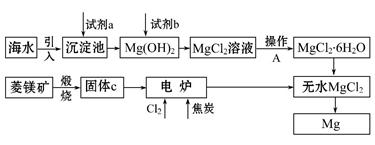
回答下列问题:
(1)试剂a的化学式是 。
(2)加入试剂b发生反应的离子方程式是
。
(3)操作A是蒸发浓缩、冷却结晶、 。
(4)在电炉中参加反应的n(Cl2)∶n(焦炭)=1∶1,则该反应的化学方程式是
。
(5)上述制镁的流程中,为降低成本、减少污染可采取的措施是(写出一种即可)
。
某种镁矿石的主要成分是碳酸镁,还含有较多的脉石(SiO2)和少量石灰石。图1所示是利用该镁矿石制备七水硫酸镁(MgSO4·7H2O)的工艺流程: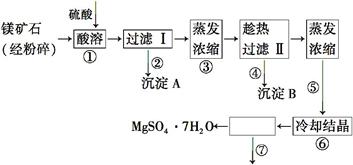
图1
已知CaSO4和MgSO4的溶解度曲线如图2所示:
根据以上信息回答下列问题:
(1)写出步骤①中碳酸镁与硫酸发生反应的化学方程式
。
(2)上述流程中多次用到了过滤操作,实验室过滤时需要用到的玻璃仪器是玻璃棒、烧杯和 。
(3)沉淀A的成分是SiO2和部分硫酸钙,过滤Ⅰ后得到的滤液中的溶质除了MgSO4还有 。
(4)步骤④趁热过滤的作用是 。
(5)步骤⑦的操作名称是 。
某校研究性学习小组同学对经初步净化处理的浓缩海水(主要含NaCl和MgSO4)进行研究。
(1)实验时若需要配制1 000 mL 0.20 mol·L-1NaOH溶液,则需要称量固体NaOH的质量为 g。
(2)取初步净化处理的浓缩海水100 mL,加入200 mL 0. 20 mol·L-1NaOH溶液,恰好把其中的Mg2+完全沉淀,则浓缩海水中Mg2+的物质的量浓度为 。
(3)研究小组同学把上述沉淀完全转化为无水MgCl2,并在熔融状态下进行电解,可得标准状况下Cl2的体积为 L。
镁及其化合物在生产和生活中有广泛的应用,试回答下列问题:
(1)常用作耐火材料的镁的化合物与盐酸反应的化学方程式为 。
(2)在军事上金属镁可以用于制造信号弹和焰火,其反应原理用化学方程式可以表示为 。
(3)Mg(OH)2是治疗胃酸过多药品的重要成分之一,其反应原理用离子方程式可以表示为 。