下列溶液中可能含有SO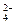 、SO
、SO 、S2-、Cl-、Br-、I-、NO
、S2-、Cl-、Br-、I-、NO 、Na+、Mg2+等离子.
、Na+、Mg2+等离子.
(1)滴入溴水后,溶液由无色变为棕黄色,并出现浑浊,则溶液中一定含有_______。
(2)若加氯化钡溶液及盐酸的混合溶液无沉淀生成.若先加入氯水,然后再加入氯化钡溶液和盐酸,有白色沉淀生成,则原溶液中一定含有_____________________。
(3)若加入氢氧化钡溶液无沉淀生成,加入硝酸银溶液也无沉淀生成,则原溶液中阴、阳离子只可能是_____________________________。
对于下列反应:2SO2 + O2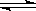 2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为________ mol/(L·min),如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ mol/L。
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为________ mol/(L·min),如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ mol/L。
大理石与盐酸反应的反应速率如右图所示,已知该反应为放热反应。
(1)写出该反应的离子反应方程式:。
(2)反应开始时反应速率加快的原因是:。
(3)反应后期反应速率下降的原因是:。
氮族元素位于元素周期表的族,其中非金属性最强的元素是。随着核电荷数的递增,氮族元素的原子半径逐渐,其气态氢化物的稳定性逐渐。
纯液体苯在其正常沸点等温汽化,则△H_____0,△S_____0。(填>,<,=)
已知反应:A(s)=D(g)+E(g),(△H-T△S)=(-4500+11T)J·mol-1,要防止反应发生,温度必须_______。