用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)烧杯间填满碎纸条的作用是 。
(3)要重复进行三次实验的目的是 。
(4)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”);当室温低于10℃时进行,对实验结果会造成较大的误差,其原因是_______ 。
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由 。
(6)用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会 ;(填“偏大、偏小、无影响”)。
(7)三次平行操作所测得的数据如下:
| 温度 序号 |
起始温度t1/℃ |
终止温度 T2/℃ |
温度差 △t/℃ |
||
| HCl |
NaOH |
平均值 |
|||
| 1 |
25 |
25 |
|
27.3 |
|
| 2 |
25 |
25 |
|
27.4 |
|
| 3 |
25 |
25 |
|
28.6 |
|
若上述HCl、NaOH溶液的密度都近似为1g/cm3,中和后生成的溶液的比热容C="4.18" J/(g·℃),则实验测得的中和热为 。
请根据官能团的不同对下列有机物进行分类。(将序号填入空格处)(共8分)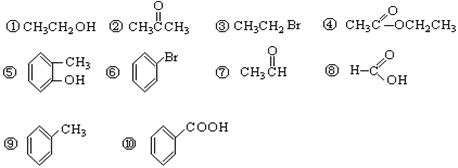
(1)芳香烃:;(2)卤代烃:;(3)醇:
(4)酚:;(5)醛:;(6)酮:
(7)羧酸:;(8)酯:。
用系统命名法命名下列物质(共6分)
①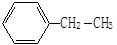 ②
② 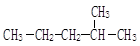 ③
③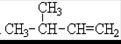
实验为测定一新配制的稀盐酸的准确浓度,通常用纯净的Na2CO3(无水)配成标准溶液进行滴定。具体操作是:称取w g无水Na2CO3装入锥形瓶中,加适量蒸馏水溶解,在酸式滴定管中加入待测盐酸滴定。
(1)锥形瓶中应加入几滴指示剂,由于CO2溶解在溶液中会影响pH,为准确起见,滴定终点宜选择在pH 4~5之间,则在中学学过的几种指示剂应选_______________,当滴定溶液由_____色变成_____色时,即表示达滴定终点.
(2)若滴到终点时,中和w g Na2CO3消耗盐酸V mL,则盐酸的物质的量浓度为________mol·L—1。
(3)若所称取的Na2CO3不纯,测得盐酸的浓度就不准确。现设盐酸的准确浓度为c1mol·L-1,用不纯的Na2CO3标定测得盐酸为c2mol·L-1,在下述情况下,c1,c2的关系是(空填>、<或=)
①当Na2CO3中含有NaHCO3时,cl_____c2;
②当Na2CO3中含有NaOH时,cl_____c2;
③当Na2CO3中含有Na2CO3·10H2O时,cl_____c2。
化合物SOCl2是—种液态化合物,沸点为77℃。在盛有10mL水的锥形瓶中,小心地滴加8滴~10滴SOC12,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出。该气体可使滴有品红试液的滤纸褪色。轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出。
(1)根据上述实验,写出SOCl2和水反应的化学方程式:_________________________
(2)AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·6H2O混合共热,可得到无水AlCl3,其原因是_________________________________________________。
相同条件下pH=3的盐酸和pH=3的醋酸:
(1)取等体积两溶液,分别稀释pH=4时,两者加水量的关系是:前者________后者(填>、<或=,下同);
(2)取等体积的两溶液,分别加入等物质的量的相应钠盐固体少量,两溶液的pH大小关系是:前者_________后者;
(3)各取两溶液VL,分别加入VLpH=11的NaOH,充分反应后,两溶液pH大小关系是:前者__________后者。