.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍(已知:氧化性Fe2+<Ni2+<Cu2+)。下列叙述正确的是
| A.阳极发生还原反应,其电极反应式:Ni2++2e-=Ni |
| B.电解过程中,阳极质量减少与阴极质量增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+ 和 Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu和Pt |
25℃时,用浓度为0.1000 mol•L-1的NaOH溶液滴定20mL 浓度均为0.1000 mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是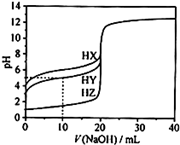
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX |
| B.根据滴定曲线,可得Ka(HY)≈10-5 |
| C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) |
D.HY与HZ混合,达到平衡时:c(H+)= +c(Z-)+c(OH-) +c(Z-)+c(OH-) |
下图是我国化学家近年来合成的两种聚乙炔衍生物分子的结构式。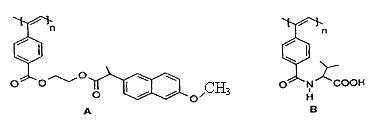
下列说法正确的是
| A.A和B均能在一定条件下水解,且水解均生成两种产物 |
| B.A水解生成的高分子化合物的单体中所有碳原子一定共面 |
| C.A和B的链节中均含有2个以上手性碳原子 |
| D.1molA和B各与热碱液反应,均最多消耗2n mol NaOH[ |
向100mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示。下列判断正确的是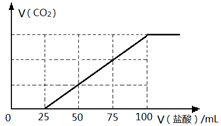
| A.原NaOH溶液的浓度为0.1 mol/L |
| B.通入CO2的体积为448 mL |
| C.所得溶液的溶质成分的物质的量之比为n(NaOH):n(Na2CO3) =" 1:" 3 |
| D.所得溶液的溶质成分的物质的量之比为n(NaHCO3):n(Na2CO3) =" 2:" 1 |
下列有关NaClO和NaCl混合溶液的叙述正确的是
| A.该溶液中,H+、NH4+、SO42-、Br-可以大量共存 |
| B.该溶液中,Ag+、NO3-、K+、CH3CHO可以大量共存 |
| C.向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+=Cl-+2Fe3++H2O |
| D.向该溶液中加入浓盐酸,每产生1mol Cl2,转移电子约为6.02×1023个 |
有机物的结构简式如图所示,则此有机物可发生的反应类型有:①取代②加成③消去④酯化⑤水解⑥氧化⑦中和。
| A.①②③⑤⑥ | B.①②③④⑤⑥⑦ | C.②③④⑤⑥ | D.②③④⑤⑥⑦ |