下列热化学方程式中,△H能正确表示物质的燃烧热的是
| A.CO(g) +1/2 O2(g) ==CO2(g)△H=-283.0 kJ/mol |
| B.C(s) +1/2 O2(g) ="=CO(g)" △H=-110.5 kJ/mol |
| C.H2(g) +1/2 O2(g)==H2O(g)△H=-241.8 kJ/mol |
| D.2C8H18(l) +25 O2(g)==16CO2(g)+18H2O(l)△H=-11036 kJ/mol |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH – 4e-+ H2O = CH3COOH + 4H+。下列有关说法正确的是()
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
| C.电池反应的化学方程式为:CH3CH2OH + O2 = CH3COOH + H2O |
| D.正极上发生的反应为:O2 + 4e-+ 2H2O = 4OH- |
反应aM(g)+bN(g)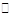 cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法正确的是( )
cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法正确的是( )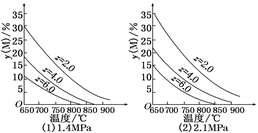
| A.同温同压同z时,加入催化剂,平衡时Q的体积分数增加 |
| B.同压同z时,升高温度,平衡时Q的体积分数增加 |
| C.同温同z时,增加压强,平衡时Q的体积分数增加 |
| D.同温同压时,增加z,平衡时Q的体积分数增加 |
设NA为阿伏加德罗常数的值。下列说法正确的是()
| A.1 L 1 mol·L-1的NaClO 溶液中含有ClO-的数目为NA |
| B.78 g 苯含有C="C" 双键的数目为3NA |
| C.常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA |
| D.标准状况下,6. 72 L NO2与水充分反应转移的电子数目为0. 1NA |
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是()
| A.同周期元素中X的金属性最强 |
| B.原子半径X>Y,离子半径X+>Z2- |
| C.同族元素中Z的氢化物稳定性最高 |
| D.同周期元素中Y的最高价含氧酸的酸性最强 |
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为( )
| A.12△H3+5△H2-2△H1 | B.2△H1-5△H2-12△H3 |
| C.12△H3-5△H2 -2△H1 | D.△H1-5△H2-12△H3 |