某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式 ,有人认为合金与烧碱溶液形成了原电池,则作为原电池负极的物质是 。
(2)由滤液A制AlCl3溶液的途径有①和②两种,你认为合理的是 。上述实验方案多处采用了过滤操作,过滤所用到的玻璃仪器有 和玻璃棒;其中玻璃棒的作用是 。
(3)用粗制氧化铜通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是: 、 。
(4)通过途径④实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥。其中“加热通氧气”所起的作用为 (用离子方程式表示)。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行 次。若测定结果x值偏高,可能的原因是 。
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
e.加热时胆矾晶体飞溅出来 f.所用坩埚事先未干燥(潮湿)
已知CH4(g)+2O2(g)== CO2(g)+2H2O(l);ΔH=-Q1kJ·mol-1,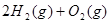 =2H2O(g);△H2=-Q2 kJ·
=2H2O(g);△H2=-Q2 kJ·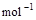 ,
,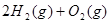 =2H2O(l);△H3=-Q3 kJ·
=2H2O(l);△H3=-Q3 kJ·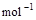 。
。
常温下,取体积比4:1的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为。
0.3mol的气态高能燃料乙硼烷(B2H6)在O2中燃烧,生成固态B2O3和液态水,放出649.5kJ的热量,其热化学方程式为________。
又知:H2O(l)=H2O(g) △H=+44kJ·mol-1,则11.2L(标准状况下)B2H6完全燃烧生成气态水时放出的热量是______kJ。
晶体具有规则的几何外形,晶体中最基本的重复单元称为晶胞。NaCl晶体结构如图所示。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体密度ρ为5.71g/cm3,晶胞边长为4.28×10-10m。(铁相对原子质量为55.9,氧相对原子质量为16)求:
(1)FexO中x值(精确至0.01)为_____________。
(2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中,Fe2+所占分数(用小数表示,精确至0.001)为___________。
(3)此晶体化学式为___________。
(4)Fe在此晶体中占据空隙的几何形状是___________(即与O2-距离最近且等距离的铁离子围成的空间形状)。
(5)在晶体中,铁元素的离子间最短距离为________m。
有一种蓝色晶体,它的结构特征是Fe2+和Fe3+分别占据立方体互不相邻的顶点,而CN-离子位于立方体的棱上。
(1)根据晶体结构特点,推出其化学式(用最简单整数示)________ __________________。
(2)此化学式带何种电荷?用什么样的离子(用Mn+表示)与其结合成中性的化学式?写出此电中性的化学式。
(3)指出(2)中添加离子在晶体结构中的什么位置。
某离子晶体晶胞结构如下图所示,x位于立方体的顶点,Y位于立方体中心。试分析:
(1)晶体中每个Y同时吸引着__________个X,每个x同时吸引着__________个Y,该晶体的化学式为__________ 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有__________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为__________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρ·cm-3,阿伏加德罗常数为NA则晶体中两个距离最近的X中心间的距离为__________ 。