选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.分液 | B.升华 | C.结晶 | D.蒸发 E.蒸馏 F.过滤 |
(1)______分离豆浆与豆渣的混合物。
(2)______从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)______分离水和食用调和油的混合物。
(4)______分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
(5)______用海水晒盐。
香豆素是一种用途广泛的香料,可用于配制香精及制造日用化妆品和香皂等。以下是某同学设计的香豆素的合成线路: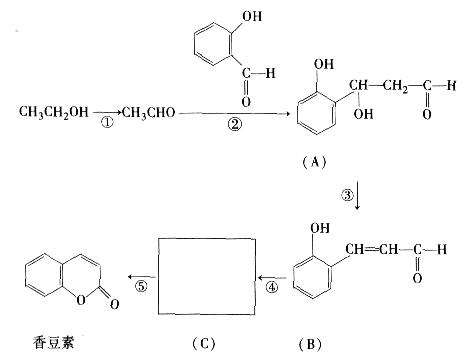
请你认真观察分析后回答以下问题:
(1)香豆素的分子式是:。
(2)写出中间产物C的结构简式,1mol C与溴水反应最多消耗mol Br2。
(3)B的同分异构体中,属于芳香族化合物且能够发生水解和银镜反应,其结构简式可能有种,写出其中任意一种的结构简式。
聚乳酸是一种新型可生物降解的高分子材料,乳酸[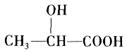 ]在催化剂作用下聚合成聚乳酸,聚乳酸材料废弃后,先水解成乳酸,乳酸在空气中微生物的作用下被氧化为CO2和H2O。
]在催化剂作用下聚合成聚乳酸,聚乳酸材料废弃后,先水解成乳酸,乳酸在空气中微生物的作用下被氧化为CO2和H2O。
(1)用化学方程式表示:乳酸合成聚乳酸的反应。乳酸在空气中微生物作用下降解的反应。
(2)如果以丙烯(CH2=CH-CH3)为主要原料(其它无机原料任选)合成乳酸,其合成过程的流程图加下: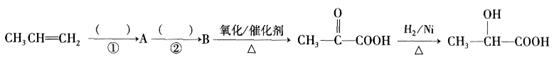
①的反应类型:②的反应条件:、加热
A的结构简式:B中含有的官能团的名称是
(3)乳酸在一定条件下可以发生消去反应生成丙烯酸,方程式为。
下图是中学中常见的五种物质及其转化关系: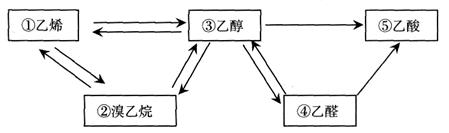
(1)上述物质中属于烃类的有(填序号)。
(2)能和碳酸氢钠反应的物质是(填序号)。反应的方程式为。
(3)实验室制取乙烯的原料是(填序号),该反应的化学方程式为,反应类型是。
(4)乙烯可用于生成聚乙烯,聚乙烯的结构简式为。其制成的塑料可以反复加热熔融加工,属于塑料(填“热塑性”或“热固性”)。
(5)写出溴乙烷发生消去反应的方程式。
现有下列物质:①乙炔②苯酚溶液③乙醛④淀粉溶液⑤氨基酸。请回答:
(1)遇碘水呈蓝色的是(填序号,下同)。
(2)能发生成肽反应的是。
(3)能跟溴发生加成反应的是。
(4)能跟银氨溶液发生银镜反应的是。
(5)能跟饱和溴水反应生成白色沉淀的是。
常温下,两种溶液:①0.1 mol/L HAC②0.1 mol/L NaAC。
(1)溶液①的pH7(填“>”、“<”或“=”),溶液中离子的电荷守恒的关系式是。
(2)溶液②呈性(填“酸”、“碱”或“中”)。其原因是(用离子方程式表示)。
(3)两种溶液中c(AC-)的大小为(填序号)。
a. 两种溶液中c(AC-)都等于0.1 mol/L
b. 两种溶液中c(AC-)都小于0.1 mol/L
c. HAC溶液中c(AC-)小于NaAC溶液中c(AC-)
(4)若将①②两溶液按一定的量混合,混合后溶液显中性,则①②两溶液的体积关系是:①②(填“=”或“>”或“<”)