有50mL NaOH溶液,向其中逐渐通入一定量的CO2,随后向溶液中逐滴加入0.1mol/L的盐酸,产生的CO2气体体积(标准状况)与所加入的盐酸的体积之间的关系如图所示: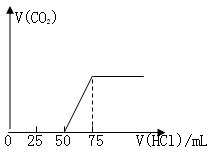
试计算:
(1)向NaOH溶液中通入CO2气体后,所得溶液
中的溶质是 ,其物质的量之比为 。
(2)产生的CO2气体体积(标准状况)是 L。
(已知:Na2CO3与HCl反应分步进行,第一步:Na2CO3+HCl=NaHCO3+NaCl;
第二步:NaHCO3+HCl=NaCl +CO2↑+H2O)
一定温度下,在容积固定的V L密闭容器中加入n mol A、2n mol B,发生反应:A(g)+2B(g) 2C(g) ΔH>0,反应达平衡后测得平衡常数为K,此时A的转化率为X。
2C(g) ΔH>0,反应达平衡后测得平衡常数为K,此时A的转化率为X。
(1)一段时间后上述反应达到平衡。则下列说法中不正确的是________(填字母)。
A.物质A、B的转化率之比为1∶1
B.起始时刻和达到平衡后容器中的压强之比为3∶(3-x)
C.充入惰性气体(如Ar),平衡向正反应方向移动
D.当2v正(A)=v逆(B)时,反应一定达到平衡状态
(2)K和x的关系满足K=____________。
(3)该反应的逆反应速率与时间的关系
如图所示。
①由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件:
t2时_________________________; t8时_________________________。
②t2时平衡向__________(填“正反应”或“逆反应”)方向移动。
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
某温度下,将2molA和3molB充入体积为2L的密闭容器中进行化学反应:A(g)+B(g) 2C(g) △H< 0,反应进行到10s时达到平衡,此时测得C的物质的量为2.4mol。回答下列问题:
2C(g) △H< 0,反应进行到10s时达到平衡,此时测得C的物质的量为2.4mol。回答下列问题:
(1)0~10s内A的平均反应速率为 。
(2)反应达平衡时B在平衡混合气体中的体积分数为 。
(3)平衡后,其他条件不变的情况下,将体积压缩到原来的1/2时,对反应产生的影响是 。
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正、逆反应速率都不变,平衡不移动,各物质物质的量不变
C.正、逆反应速率都增大,平衡不移动,B的物质的量浓度为1.8mol/L
D.正、逆反应速率都增大,平衡不移动,各物质的物质的量不变
(4)可以证明恒温恒容条件下该可逆反应已达到平衡状态的是 。
A.混合气体的密度不随时间而改变
B.混合气体的平均摩尔质量不随时间而改变
C.B和C在混合气体中的体积分数之比不随时间而改变
D.在隔热条件下,体系的温度不随时间而改变
(5)若在其他条件不变的情况下,采取下列措施反应达平衡C的百分含量不变的是 。
A.通入He气 B.使用催化剂
C.升高温度D.再充入1molA和1.5molB
(6)若保持原温度和容器容积不变再向其中充入2molA和1molB,平衡常数将 (填“增大” “减小”或“不变”),整个过程中物质B的转化率为 。
(1)下列ΔH表示物质燃烧热的是 ;表示中和热ΔH="-" 57.3 kJ·mol-1的是 。(填“ΔH1”、“ΔH2”和“ΔH3”等),ΔH1 ΔH3(填“>”、“<”或“=”)
| A.C(s)+1/2O2(g) = CO(g)ΔH1 |
| B.2H2(g)+O2(g) = 2H2O(l) ΔH2 |
| C.C(s)+O2(g)= CO2(g) ΔH3 |
D. Ba(OH)2(aq)+ Ba(OH)2(aq)+ H2SO4(aq)= H2SO4(aq)=  BaSO4(s)+H2O(l) ΔH4 BaSO4(s)+H2O(l) ΔH4 |
E.NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(l)ΔH5
F.2NaOH(aq)+H2SO4(aq)= Na2SO4(aq)+2H2O(l) ΔH6
(2)在25℃、101kPa下,0.2mol液态甲醇燃烧生成CO2气体和液态水时放热144.0kJ。则表示甲醇燃烧热的热化学方程式为 。
(3)用“>”、“<”或“=”填空:
①同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件的热效应(化学计量数相同)分别为ΔH1、ΔH2,则ΔH1________ΔH2。
②相同条件下,2 mol氢原子所具有的能量________1 mol 氢分子所具有的能量。
③等质量的硫蒸汽、硫磺、分别在足量空气中燃烧所对应的热效应分别为ΔH1 、ΔH2 则ΔH1________ΔH2。
25 ℃,101 k Pa时,已知下列可逆反应的焓变和化学平衡常数分别为:
①(g)+2B(g) 2C(g)+2D(l) ΔH1=-250.kJ·mol-1 K1=0.2
2C(g)+2D(l) ΔH1=-250.kJ·mol-1 K1=0.2
②(s)+B(g) C(g) ΔH2=-310 kJ·mol-1 K2=2
C(g) ΔH2=-310 kJ·mol-1 K2=2
③(g)+ B(g)
B(g) D(l) ΔH3=-200 kJ·mol-1 K3=0.8
D(l) ΔH3=-200 kJ·mol-1 K3=0.8
(1)则反应2E(s)+2F(g)+B(g) A(g)的ΔH= ,K= 。
A(g)的ΔH= ,K= 。
(2)写出反应①的平衡常数表达式: 。
(3)反应②的逆反应的平衡常数K4= 。
(4)对反应①而言,升高温度平衡常数 ,增大压强平衡常数 。(填“增大或降低或不变”)
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:甲醇合成反应:
(i)CO(g) + 2H2(g) = CH3OH(g) △H1 = -90.1kJ•mol-1
(ii)CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H2 = -49.0kJ•mol-1
水煤气变换反应:
(iii)CO(g) + H2O(g) = CO2(g) + H2 (g) △H3 = -41.1kJ•mol-1
二甲醚合成反应:
(iV)2 CH3OH(g) = CH3OCH3(g) + H2O(g) △H4 = -24.5kJ•mol-1
(1)分析二甲醚合成反应(iV)对于CO转化率的影响 。
(2)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响: 。
(3)有研究者在催化剂(含Cu—Zn—Al—O和Al2O3)、压强为5.0MPa的条件下,由H2和CO直接制备二甲醚,结果如下图所示。其中CO转化率随温度升高而降低的原因是: 。