一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)  CH3OH(g)。根据题意完成下列各题:
CH3OH(g)。根据题意完成下列各题: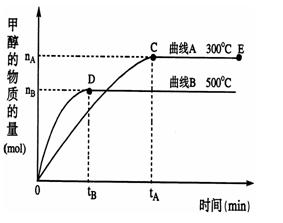
(1) 判断该反应达到平衡状态的标志是 。(填字母)
a.CO和CH3OH浓度相等 
b.CO百分含量保持不变
c.容器中气体的压强不变
d.CH3OH的生成速率与CO的消耗速率相等
e.容器中混合气体的密度保持不变
(2) 欲提高CO的转化率,下列措施可行的是
。(填字母)
a.向装置中再充入N2 b.向装置中再充入H2
c .改变反应的催化剂 d.升高温度
.改变反应的催化剂 d.升高温度
(3) 反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(4) 在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(5) 在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
次磷酸(H3PO2)可发生下列反应而用于化学镀银。
Ag++H3PO2+H2O —Ag +H3PO4+H+
试回答下列问题:
H3PO2中,P元素的化合价为________;该反应中,H3PO2做(氧化剂、还原剂)
H3PO2是一种中强酸,写出其电离方程式:。
配平离子方程式。
用双线桥法标出电子转移的数目。
若反应中生成5.4 g Ag,则转移电子个数为。
已知重水(D2O)和乙酸之间会发生氢交换:
D2O+CH3COOH CH3COOD+HDO
CH3COOD+HDO
次磷酸(H3PO2)与D2O之间也能发生氢交换,但次磷酸钠(NaH2PO2)与D2O之间不能发生氢交换,从分类来看,NaH2PO2属于
| A.正盐 | B.酸式盐 | C.钠盐 | D.氧化物 |
(1)某0.2 L,浓度为c的BaCl2溶液中含1 mol Cl-,则c=mol/L。
(2)已知16gA和20gB恰好完全反应生成0.04mol C和31.76gD,则C的摩尔质量为
(3)经测定0.1 mol/L的KHSO4溶液与0.1 mol/L的盐酸中的氢离子浓度几乎相同,则该浓度的KHSO4溶液与铁粉反应的离子方程式为。
以下物质:①NH3 ②BaCO3固体 ③酒精 ④盐酸 ⑤Cu ⑥NaCl晶体 ⑦纯醋酸
能导电的是(填编号,下同),属于电解质的有。
(2)9g H2O分子所含氢原子数与 L CH4(标准状况下)所含氢原子数相等;
(3)同温同压下,0.6mol O2与9.6g O3的原子个数比为,体积比为。
(1)将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
①在反应体系中加入催化剂,反应速率,该反应的反应热(填“增大”、“减小”或“不变”)。
②5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率v(N2)=,H2的转化率为(保留小数点后一位)。
③欲提高②容器中H2的转化率,下列措施可行的是。
| A.把气体的体积压缩至1L | B.向容器中再充入惰性气体 |
| C.改变反应的催化剂 | D.液化生成物分离出氨 |
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K |
303 |
313 |
323 |
| NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
此合成反应的a0。(填“大于”、“小于”或“等于”)
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和液态水,放出327.04kJ的热量。
(1)写出该反应的热化学方程式___________________________________。
(2)已知H2O(l)==H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和气态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。