某结晶水合物中有 两种阳离子和一种阴离子,所含元素均为短周期元素,为确定组成,某同学进行如下实验:称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g。
两种阳离子和一种阴离子,所含元素均为短周期元素,为确定组成,某同学进行如下实验:称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g。
(1)该结晶水合物中含有的两种阳离子是 __ 和 __ ,阴离子是 。
(2)试通过计算确定该结晶水合物的化学式。
3)假设过 程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol·L-1,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol·L-1,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
有下列物质:①钠,②过氧化钠,③碳酸钠,④碳酸氢钠。用序号填空:
(1)受热分解可得到 Na2CO3的是。
(2)可用于漂白织物、麦秆、羽毛的是。
(3)广泛用于玻璃、肥皂、造纸、纺织工业的是。
(4)可用来提炼钛、铌、钽的是。
(5)可作为飞船宇航员供氧剂的是。
下图是中学教材中元素周期表的一部分,试回答下列问题:
| ① |
||||||||||||||||||||||||
| ② |
③ |
④ |
⑤ |
|||||||||||||||||||||
| ⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
11 |
|||||||||||||||||||
| 12 |
13 |
|||||||||||||||||||||||
| 14 |
15 |
|||||||||||||||||||||||
(1)在上表所列出的短周期元素中(填具体物质化学式)
①性质 最不活泼的是 ;
②原子半径最小的是(除稀有气体元素) _ 。简单阴离子半径最大的是。
③形成的气态氢化物最稳定的是;
④最高价氧化物对应的水化物酸性最强的是,
⑤在⑤⑩15三种元素形成的阴离子中还原性最强的是,
⑥可作半导体的是(填表中编号)
(2)用电子式表示②与④形成的化合物的形成过程 __。
(3)⑨与12形成的化合物溶于水所克服的微粒间作用力为。
(4)13在元素周期表中的位置是,元素③形成的单质的结构式为。
(5)________(填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,其单质与氢氧化钠溶液反应的离子方程式是___________________________________________。
(6) “神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的____(填表中编号)元素组成的,用化学方程式表示吸收原理:_______________________。
(7)设②的原子序数为Z,则14的原子序数为(用Z表示)。
考查知识点:根据元素周期表,①比较金属性,非金属性,对应粒子还原性及半径的大小;②判断元素在周期表的位置;③化学键 ④位置确定序数;⑤位置推测用途
下列微粒中:①O3②1H+③KOH④2 H⑤H2O2⑥H2⑦NH4Cl⑧3H⑨H2SO4⑩MgF2 234U12O213Cl214Ar 15Na2O2
234U12O213Cl214Ar 15Na2O2
(1)上述物质中,属于核素的是__________________ (填序号,下同),
(2)互为同素异形体的是______________,
(3)只存在共价键的化合物是,
(4)只存在离子键的是,
(5)既存在离子键又存在极性共价键的是,
(6)既存在离子键又存在非极性共价键的是。
考查知识点:(1)核素的概念,(2)同素异形体的概念,(3)共价键、化合物的判断,(4) (5) (6)离子键、极性键、非极性键的判断。
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验: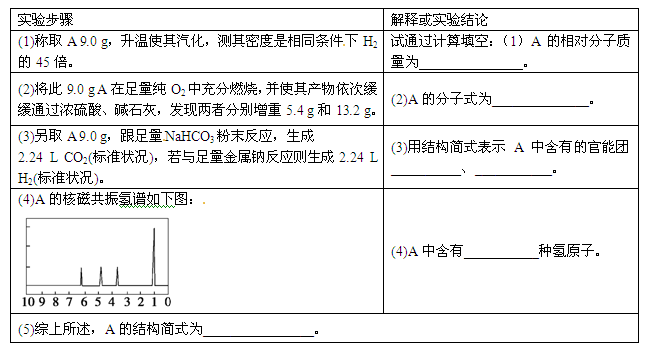
(8分) 有的油田开采的石油中溶有一种碳氢化合物——金刚烷,它的分子立体结构如图所示: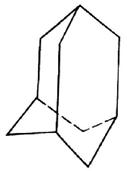
(1)由图可知其分子式为:____________。
(2)它是由_________ 个六元环构成的六体的笼状结构,其中有__________个碳原子为三个环共有。
(3)金刚烷分子的一氯代物有_______种。