设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.常温下,4.48 L N2和O2的混合气体所含原子数为0.4NA |
| B.常温下,1.0L 1.0 mol·L-1NaAlO2溶液中含有的氧原子数为2NA |
| C.7.8 g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| D.0.1 mol Fe参加氧化还原反应,转移的电子数目一定是0.2 NA |
设阿伏加德罗常数为NA。则下列说法正确的是()
| A.标准状况下,11.2L SO3含有的硫原子数为0.5NA |
| B.5.6 g铁与足量硫的反应中,铁失去的电子数为0.3NA |
| C.1.8g的NH4+离子中含有的电子数为NA |
| D.1L 1mol/L的盐酸中,所含氯化氢分子的数目为NA |
在目前的长式周期表中,同一主族的两种元素原子的核外电子数的差值可能为()
| A.6 | B.12 | C.26 | D.30 |
对于某些离子的检验及结论一定正确的是
| A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32¯ |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42¯ |
| C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
下列离子方程式正确的是
| A.用碳酸钠溶液吸收少量二氧化硫: 2CO32-+SO2+H2O=2HCO3-+HSO3- |
| B.硅酸钠溶液中通人足量二氧化碳:SiO32—+2CO2+3H2O==H4SiO4↓+2HCO3— |
C.向硫酸氢钾溶液中加入Ba(OH)2溶液至刚好沉淀完全:2H++SO +Ba2++2 +Ba2++2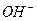 =2H2O+BaSO4↓ =2H2O+BaSO4↓ |
| D.小苏打溶液中加入过量的澄清石灰水: |
2HCO3— + Ca2+ + 2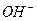 ="=" CaCO3↓+2H2O + CO32-
="=" CaCO3↓+2H2O + CO32-
已知某元素原子核内的质子数为m,中子数为n,则下列结论正确的是
| A.这种元素的相对原子质量为m+n |
| B.不能由此确定该元素的相对原子质量 |
| C.若碳原子的质量为W克,则此原子的质量为(m+n)W克 |
| D.核内中子的总质量小于质子的总质量 |