实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应: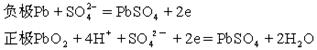
今若制得Cl20.050mol,这时电池内消耗的H2SO4的物质的量至少是
| A.0.025mol | B.0.050mol | C.0.10mol | D.0.20mol |
下列溶液中溶质的物质的量浓度为1mol/L的是()
| A.将58.5gNaCl溶解在1L水中 |
| B.将1L10mol/L的浓盐酸加入9L水中 |
| C.将22.4LHCl气体溶于水配成1L溶液 |
| D.将10gNaOH溶解在少量水中,再加蒸馏水直到溶液体积为250mL |
水资源非常重要,联合国确定2003年为国际淡水年。海水淡化是海岛地区提供淡水的重要手段,所谓海水淡化是指除去海水中的盐分以获得淡水的工艺过程(又称海水脱盐),其方法较多,如反渗透法、水合物法、电渗透法、离子交换法和压渗法等。下列方法中也可以用来进行海水淡化的是()
| A.过滤法 | B.蒸馏法 | C.分液法 | D.冰冻法 |
某溶液中含有Fe2+和I -。为了氧化I -而不使Fe2+被氧化,试根据下列三个反应判断,可选用的氧化剂是()
①2Fe3++2I-=2Fe2++I2
②2Fe2++Cl2=2Fe3++2Cl-
③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
| A.FeCl2 | B.KMnO4 | C.Cl2 | D.FeCl3 |
在某无色透明的酸性溶液中,能大量共存的离子组是()
| A.Na+ 、K+、SO42-、HCO3- | B.Cu2+、K+、SO42-、NO3- |
| C.Na+、 K+、Cl-、 NO3- | D.Fe3+、K+、SO42-、Cl- |
能正确表示下列化学反应的离子方程式的是()
| A.氢氧化钡溶液与硫酸的反应 OH-+H+= H2O |
| B.澄清的石灰水与稀盐酸反应Ca(OH)2 + 2H+= Ca2+ + 2H2O |
| C.铜片插入硝酸银溶液中 Cu + Ag+= Cu2+ + Ag |
| D.碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2 |