⑴高温下,某反应达到平衡,平衡常数K= 。
。
①该反应化学方程式为 。
②若恒容时,温度升高,H2浓度减小,则该反应焓变为 (填正值或负值)。
③恒温恒压下,若继续向原平衡混合物的容器中通入少量氦气(假设氦气和各物质不反应)后,化学平衡 移动;反应物的转化率 (填增大、减小、或不变);H2的浓度
(填增大、减小、或不变);
⑵可逆反应: X+ 3Y(g)  2Z(g) +2W(g)达到平衡,混
2Z(g) +2W(g)达到平衡,混
合物中Y的体积分数随压强(P)与温度T(T2>T1)的变化关系如图示。
①当压强不变时,升高温度,Y的体积分数变 ,
平衡向 方向移动,则正反应是 热反应。
②当温度不变时,增大压强,Y的体积分数变 ,
平衡向 方向移动,则X的状态是
在一个容积固定的反应器中,有一可左右滑动的密封隔板,左、右两侧分别进行如下可逆反应:2SO2(g)+O2(g) 2SO3(g);
2SO3(g);
3Fe(s)+4H2O(g)  Fe3O4(g)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25mol、1mol;右侧中加入9 mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)。
Fe3O4(g)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25mol、1mol;右侧中加入9 mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)。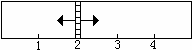
当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器位置2处。请填写以下空白:
(1)若x=1.5,则左侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行。欲使反应维持向该方向进行,则x的取值范围是________________。
(2)若x=2,则左侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行,平衡时混合气中SO2所占的体积分数为_________。
由于Fe (OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe (OH)2沉淀,应用下图电解实验可以制得白色的纯净的Fe (OH)2沉淀。两电极材料分别为石墨和铁。
(1)b电极材料应为____,电极反应式为________________。
(2)电解液C可以是__________。
| A.纯净水 | B.NaCl溶液 | C.NaOH溶液 | D.CuCl2溶液 |
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g) 2SO3(g);△H<0
2SO3(g);△H<0
(1)该反应450℃时的平衡常数500℃时的平衡常数(填“大于”、“小于”或“等于”)。
(2)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0. 10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则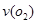 =mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡移动(填“向正反应方向”、“向逆反应方向” 或“不”)
=mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡移动(填“向正反应方向”、“向逆反应方向” 或“不”)
在一定条件下,反应x A+YB zC达到平衡:
zC达到平衡:
(1)若A、B、C均为气体,则该反应的平衡常数表达式为_______________________;
(2)若A、B、C均为气体,减压后平衡向逆反应方向移动,则x、y、z间的关系是___________;
(3)已知C是气体,且x+y=z,在增大压强时,若平衡发生移动,则一定向________(填“正”或“逆”)反应方向移动
已知可逆反应CO+H2O(g)  CO2+H2,达到平衡时,K=
CO2+H2,达到平衡时,K=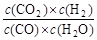 ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。
(1)830K时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为;K值为。
(2)830K,若只将起始时c(H2O)改为6mol/L,则水蒸气的转化率为。
(3)若830K时,起始浓度c(CO)=a mol/L,c(H2O)=b mol/L,H2的平衡浓度c(H2)=c mol/L,a、b、c之间的关系式是。