A.B.C是短周期的三种相邻元素。A.B同主族,B.C同周期;这三种元素的质子数之和为38,最外层电子数之和为16。
(1)则它们的元素符号分别为A______,B______,C______。
(2)A元素在周期表中的位置,第 周期,第 族,A单质的电子式为 。
工业上为了处理含有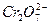 的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准。请回答下列问题:
的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准。请回答下列问题:
(1)两极发生的电极反应式为:阴极:______________;阳极:__________________。
(2)写出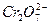 变为Cr3+的离子方程式:__________________________。
变为Cr3+的离子方程式:__________________________。
(3)工业废水由酸性变为碱性的原因是:___________________________。
(4)_________(填“能”或“不能”)改用石墨电极,原因是______________________。
在常温、常压下,用铂作电极电解CuSO4溶液。通电一段时间,切断电源,一个电极的质量增加了0.127 g,另一电极的气体产物的质量应是__________g,溶液的pH________(填“增大”“减少”或“不变”)。
用铂电极电解氢氧化钠溶液,测定两极逸出气体的体积,记录如下
| 时间/min气体体积/L |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| 阴极生成的气体 |
6 |
12 |
20 |
29 |
39 |
49 |
59 |
69 |
| 阳极生成的气体 |
2 |
4 |
7 |
11 |
17 |
23 |
28 |
34 |
(1)完成有关的电极反应式:阴极__________;阳极____________;
(2)完成电解的总化学方程式_______________________________;
(3)开始电解阶段两极产生气体的体积比不符合理论比值的原因是______________________;
(4)自第__________分钟起阴极与阳极产生气体的体积比约为理论的比值;
(5)该过程NaOH溶液的pH如何变化__________________________________。
试计算下列溶液的pH(均在25 ℃时):
(1)0.1 mol·L-1 NaOH溶液与0.1 mol·L-1 Ba(OH)2溶液等体积相混后溶液的pH为_____。
(2)将0.1 mol·L-1盐酸与0.6 mol·L-1Ba(OH)2溶液等体积相混后溶液的pH为________。
(3)将0.1 mol·L-1的稀H2SO4稀释1010倍后,溶液中c(H+)∶c( )=______________。
)=______________。
某学生在实验室测定溶液的pH时,先将pH试纸用蒸馏水润湿后再进行测定,其测定结果是否一定有误差?_____________,理由是_______________________________________。若用此方法分别测定c(H+)相等的H2SO4和H3PO4的pH,误差较大的是_____________,理由是_______________________________________。