下列实验操作正确的是
| A.用洁净的玻璃棒蘸取试液,点在湿润的pH试纸上测定试液pH |
| B.将称量好的固体直接加入容量瓶中,加水溶解并稀释至刻度,配制成一定物质的量浓度的溶液 |
| C.欲从碘水中分离出I2,可将适量的CCl4加入碘水中振荡静置分层后分液 |
| D.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用 |
某烷烃的结构为: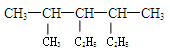 ,下列命名正确的是 ()
,下列命名正确的是 ()
| A.2,4 -二甲基 -3-乙基己烷 | B.3-异丙基 -4-甲基已烷 |
| C.2-甲基-3,4-二乙基戊烷 | D.3-甲基-4-异丙基已烷 |
下列变化属于物理变化的是 ( )
| A.煤的干馏 | B.石油的分馏 | C.重油的裂化 | D.石油的裂解 |
下列分子式表示的物质一定是纯净物的是()
| A.CH4O | B.C7H8O | C.C2H4Cl2 | D.C5H10 |
下列有机物中,不属于烃的衍生物的是()
| A.醋酸 | B.酒精 | C.四氯化碳 | D.邻二甲苯 |
将0.05molSO2(g)和0.03molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)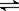 2SO3(g),在一定条件下达到平衡,测得c(SO3)=0.04mol·L-1。以下表述正确的是
2SO3(g),在一定条件下达到平衡,测得c(SO3)=0.04mol·L-1。以下表述正确的是
| A.该条件下反应的平衡常数为1.6×103 |
| B.通常情况下,该反应一定能自发进行 |
| C.题给条件下,O2的转化率是20% |
| D.当体系中SO2和SO3的速率之比是1:1时,则该反应达到化学平衡状态 |